题目内容
同学在学化学时走向社会和工厂,在实地参观中学到了许多书本上所没有的知识,比如学会了对样品试样的分析;他们从工厂带回一块小矿石,对其化合物的组成进行了实验,装置如下图:

铜的氧化物CaCl2干燥剂实验结果如下:
(玻璃管的质量为80.2g)
| 实验前 | 实验后 | |
| 铜的氧化物+玻璃管 | 137.8g | 131.4g |
| 氯化钙+U型管 | 100.8g | 108.0g |
(1)完全反应后生成水的质量为:________;
(2)生成的水中氧的质量为:________;
(3)铜的氧化物中铜的质量为:________;
(4)铜的氧化物中铜和氧的质量比为:________;
(5)计算铜的氧化物中铜、氧原子个数比为________,确定该氧化物的化学式为________.
解:(1)完全反应生成的水,由于被干燥剂氯化钙所吸收,因此水的质量为:108.0g-100.8g═7.2g,故答案为:7.2g
(2)由于水的质量为7.2g,所以水中氧元素的质量:7.2g×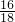 ×100%═6.4g,故答案为:6.4g
×100%═6.4g,故答案为:6.4g
(3)铜的氧化物中氧元素就是生成的水中氧元素的,所以铜元素的质量:137.8g-80.2g-6.4g=51.2g,故答案为:51.2g
(4)铜的氧化物中有氧元素6.4g,铜元素51.2g,因此铜、氧元素的质量比为:51.2g:6.4g=8:1,故答案为:8:1
(5)可以根据元素的质量比直接求元素的原子个数比,氧化物中铜、氧元素的原子个数比为: :
: =2:1,因此该氧化物是Cu2O,故答案为:2:1,Cu2O
=2:1,因此该氧化物是Cu2O,故答案为:2:1,Cu2O
分析:铜的氧化物减少的质量即被夺走得氧元素的质量,即是生成的水中所含氧元素的质量;而氯化钙增加的质量就是吸收的生成的水的质量.
点评:主要根据实验来确定化合物的组成,考查了对化学式的有关计算,培养学生的理解能力和计算能力.
(2)由于水的质量为7.2g,所以水中氧元素的质量:7.2g×
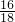 ×100%═6.4g,故答案为:6.4g
×100%═6.4g,故答案为:6.4g(3)铜的氧化物中氧元素就是生成的水中氧元素的,所以铜元素的质量:137.8g-80.2g-6.4g=51.2g,故答案为:51.2g
(4)铜的氧化物中有氧元素6.4g,铜元素51.2g,因此铜、氧元素的质量比为:51.2g:6.4g=8:1,故答案为:8:1
(5)可以根据元素的质量比直接求元素的原子个数比,氧化物中铜、氧元素的原子个数比为:
 :
: =2:1,因此该氧化物是Cu2O,故答案为:2:1,Cu2O
=2:1,因此该氧化物是Cu2O,故答案为:2:1,Cu2O分析:铜的氧化物减少的质量即被夺走得氧元素的质量,即是生成的水中所含氧元素的质量;而氯化钙增加的质量就是吸收的生成的水的质量.
点评:主要根据实验来确定化合物的组成,考查了对化学式的有关计算,培养学生的理解能力和计算能力.

练习册系列答案
相关题目
同学在学化学时走向社会和工厂,在实地参观中学到了许多书本上所没有的知识,比如学会了对样品试样的分析;他们从工厂带回一块小矿石,对其化合物的组成进行了实验,装置如下图:

铜的氧化物CaCl2干燥剂实验结果如下:
(玻璃管的质量为80.2g)
试根据实验数据求:
(1)完全反应后生成水的质量为: ;
(2)生成的水中氧的质量为: ;
(3)铜的氧化物中铜的质量为: ;
(4)铜的氧化物中铜和氧的质量比为: ;
(5)计算铜的氧化物中铜、氧原子个数比为 ,确定该氧化物的化学式为 .

铜的氧化物CaCl2干燥剂实验结果如下:
(玻璃管的质量为80.2g)
| 实验前 | 实验后 | |
| 铜的氧化物+玻璃管 | 137.8g | 131.4g |
| 氯化钙+U型管 | 100.8g | 108.0g |
(1)完全反应后生成水的质量为:
(2)生成的水中氧的质量为:
(3)铜的氧化物中铜的质量为:
(4)铜的氧化物中铜和氧的质量比为:
(5)计算铜的氧化物中铜、氧原子个数比为
同学在学化学时走向社会和工厂,在实地参观中学到了许多书本上所没有的知识,比如学会了对样品试样的分析;他们从工厂带回一块小矿石,对其化合物的组成进行了实验,装置如下图:

铜的氧化物CaCl2干燥剂实验结果如下:
(玻璃管的质量为80.2g)
试根据实验数据求:
(1)完全反应后生成水的质量为:______;
(2)生成的水中氧的质量为:______;
(3)铜的氧化物中铜的质量为:______;
(4)铜的氧化物中铜和氧的质量比为:______;
(5)计算铜的氧化物中铜、氧原子个数比为______,确定该氧化物的化学式为______.

铜的氧化物CaCl2干燥剂实验结果如下:
(玻璃管的质量为80.2g)
| 实验前 | 实验后 | |
| 铜的氧化物+玻璃管 | 137.8g | 131.4g |
| 氯化钙+U型管 | 100.8g | 108.0g |
(1)完全反应后生成水的质量为:______;
(2)生成的水中氧的质量为:______;
(3)铜的氧化物中铜的质量为:______;
(4)铜的氧化物中铜和氧的质量比为:______;
(5)计算铜的氧化物中铜、氧原子个数比为______,确定该氧化物的化学式为______.