题目内容
【题目】2020年面对突如其来的新型冠状病毒,越来越多的人意识到日常清洁消毒的重要性。医用酒精、84消毒液成为每个家庭必备的消毒用品。
交流与讨论一、关于酒精:
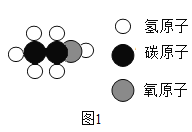
(1)下图是酒精(C2H5OH)分子的微观模拟图1,酒精的学名是_____,属于_____(填序号)。
A 化合物 B 氧化物 C 无机物 D 有机物
(2)酒精可作燃料,燃烧时放出大量的热,其化学反应方程式为_____,使酒精具备能燃烧这一性质的微粒是_____(填微粒名称);熄灭酒精灯时用灯帽盖灭,依据的灭火原理是_____。
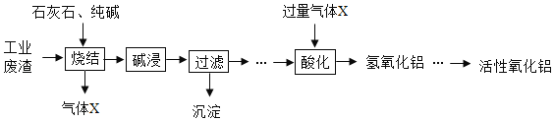
(3)酒精是可再生能源,利用农作物秸秆生产酒精的主要流程如图2所示,请回答下列问题:
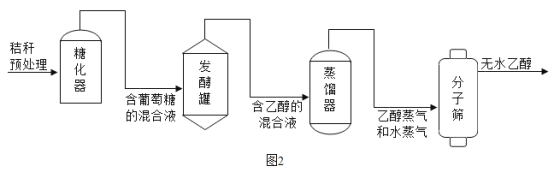
发醇罐中,葡萄糖(C6H12O6)在酒化酶的催化作用下发生反应的化学方程式为:C6H12O6 2C2H5OH+2X↑,则X的化学式为_____,该反应属于_____反应(填基本反应类型)。
2C2H5OH+2X↑,则X的化学式为_____,该反应属于_____反应(填基本反应类型)。
(4)医用体积分数75%的酒精溶液作消毒剂,此酒精溶液的溶剂是_____(填物质名称)。
[查阅资料]配制100mL医用酒精,可以量取79mL 95%的酒精溶液,并加水稀释至100mL。
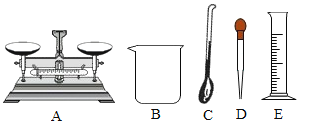
I.量取75mL 95%的酒精溶液,可选用的仪器是_____(如图所示,填序号)。
Ⅱ.小明将79mL 95%酒精溶液和21mL蒸馏水混合,发现体积小于100mL,请用微粒的观点解释其原因_____。
Ⅲ.在老师的指导下,小明选用容量瓶(可精确地配制一定浓度溶液的仪器)79mL 95%的酒精溶液并加水至10mL刻度配制75%的酒精溶液。
交流与讨论二、关于“84消毒液”:
“84消毒液”说明书上的部分信息如下:
主要成分:NaClO
杂质成分:NaCl、NaOH
净含量:500mL
主要性能:具有碱性、漂白性和腐蚀性
保存方法:密封、避光、低温保存
使用范围:适用于一般物体的表面消毒
注意事项:不可与其他洗涤剂或消毒液混合使用
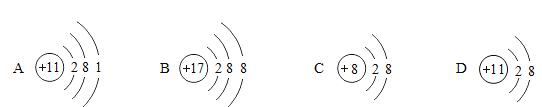
(1)NaCl、NaClO、NaOH中阳离子的结构示意图为_____(填序号)。
(2)常温下,该消毒液的pH_____(填序号)。
A 大于7
B 等于7
C 小于7
(3)工业上将氯气(Cl2)通入烧碱溶液中可制取消毒液,反应后形成了NaCl和NaClO的溶液,该反应的化学方程式为_____。
(4)“84消毒液”(主要成分是NaClO) 和洁厕剂(主要成分是盐酸) 混合使用会产生有毒气体,可能导致中毒,小美猜想有毒气体可能是氯气,她猜想的依据是_____。
(5)探究NaClO的漂白性
[查阅资料]
次氯酸钠(NaClO) 能与水反应,水溶液能释放氧气,反应的过程为NaClO+H2O=HClO+NaOH;2HClO![]() 2HCl+O2↑,该过程中化合价发生变化的元素有_____,次氯酸(HClO) 能使染料和有机色质褪色,可用作漂白剂。
2HCl+O2↑,该过程中化合价发生变化的元素有_____,次氯酸(HClO) 能使染料和有机色质褪色,可用作漂白剂。
[进行实验]选用红色纯棉布条进行如图实验:
编号 | ① | ② | ③ | ④ |
实验操作 |
|
|
|
|
5min后 | 布条略变浅 | 布条变为粉色 | 布条变为粉色 | 布条变为乳黄色 |
[解释与结论]
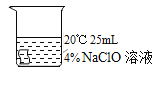
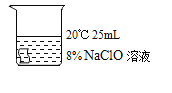
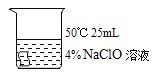
I.实验中,欲得出“其他条件相同时,升高温度可使次氯酸钠溶液的漂白性增强”的结论,需要对比_____。
实验(填编号):
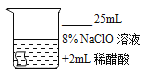
Ⅱ.试分析实验④应控制的温度条件及设计该实验的目的是_____。
Ⅲ.根据实验,请你再提出一条使用“84消毒液”消毒时的注意事项_____。
【答案】乙醇 AD 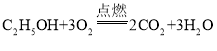 乙醇分子 可燃物与氧气隔绝 CO2 分解反应 水 DE 分子之间有间隔 D A Cl2+2NaOH=NaCl+NaClO+H2O 化学反应前后元素种类不变,反应物中含有氯元素,所以有毒气体为氯气 Cl、O ①③ 20℃时探究稀醋酸对次氯酸钠漂白性的影响 有颜色衣物不宜使用84消毒液消毒
乙醇分子 可燃物与氧气隔绝 CO2 分解反应 水 DE 分子之间有间隔 D A Cl2+2NaOH=NaCl+NaClO+H2O 化学反应前后元素种类不变,反应物中含有氯元素,所以有毒气体为氯气 Cl、O ①③ 20℃时探究稀醋酸对次氯酸钠漂白性的影响 有颜色衣物不宜使用84消毒液消毒
【解析】
交流与讨论一、关于酒精:
(1)酒精俗称为乙醇,含有碳氢氧三种元素,所以是化合物,同时含有碳元素,因此还是有机物;
故答案为:乙醇;AD;
(2)酒精与氧气在点燃条件下反应生成水和二氧化碳,书写化学方程式注意配平;参与反应的是分子,因此具有燃烧性的为乙醇分子;灯帽覆盖后,可燃物酒精与氧气隔绝,所以燃烧停止,变为熄灭;
故答案为: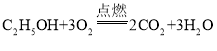 ,乙醇分子,可燃物与氧气隔绝;
,乙醇分子,可燃物与氧气隔绝;
(3)根据质量守恒定律,化学反应前后,原子的种类和数目不变,反应物中含6个碳原子、12个氢原子、6个氧原子,生成物中含4个碳原子、12个氢原子、2个氧原子,故生成物中还应有2个碳原子和4个氧元素,而X系数为2,所以X为二氧化碳;由一种反应物生成多种生成生成物,所以符合分解反应特点;
故答案为:CO2;分解反应;
(4)酒精溶解在水中,形成75%的医用酒精,所以溶剂为水;
故答案为:水;
[查阅资料]
Ⅰ:量取酒精液体时,需要用量筒进行量取,同时在接近所需体积时,需要胶头滴管滴加至所需体积;
故答案为:DE;
Ⅱ:分子之间有间隔,所以当两者分子混合后,会进入间隔中,使体积减小;
故答案为:分子之间有间隔;
交流与讨论二、关于“84消毒液”:
(1))NaCl、NaClO、NaOH中阳离子为钠离子,阳离子中核内质子数大于核外电子数,只有D符合要求;
故答案为:D;
(2)杂质有氢氧化钠,所以溶液显碱性,pH大于7;
故答案为:A;
(3)氯气与氢氧化钠反应生成了氯化钠和次氯酸钠,还缺少氢元素,没有气体生成,因此可以组合生成水,所以氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,据此书写化学方程式;
故答案为:![]() ;
;
(4)次氯酸钠与盐酸反应生成有毒气体,根据含有的元素,可以看出能生成有毒气体只有氯元素,生成氯气;
故答案为:化学反应前后元素种类不变,反应物中含有氯元素,所以有毒气体为氯气;(5)根据化学方程式,可以看出氯元素由+1变为﹣1,氧元素由﹣2变为0,所以发生化合价变化的为氯和氧元素;
故答案为:Cl、O;
[解释与结论]
Ⅰ:根据对比实验要求,找到温度升高的两组实验即可,①和③只有温度一个变量,其他实验条件一致,因此可以得出实验结论温度对漂白性强弱的影响;
故答案为:①③;
Ⅱ:④中除了加入稀醋酸,与其他实验相比,以及存在变量,所以要保证其他条件不变,所以选择温度一致浓度相同的②做对比实验,所以温度应该一致为20℃,探究变量醋酸的影响;
故答案为:20℃时探究稀醋酸对次氯酸钠漂白性的影响;
Ⅲ:根据实验次氯酸钠具有漂白性,因此有颜色的衣物不得用84消毒液进行消毒,否则会褪色;
故答案为:有颜色衣物不宜使用84消毒液消毒。

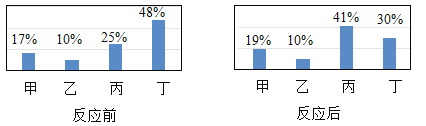
【题目】某校初三学生去西樵山春游,带回了几块石灰石样品。为了检测样品中碳酸钙的含量,甲、乙、丙、丁四位同学用质量分数相同的盐酸与样品充分反应来进行测定![]() 假设样品中的杂质不溶于水,且不与盐酸反应
假设样品中的杂质不溶于水,且不与盐酸反应![]() ,测得数据如表:
,测得数据如表:
甲 | 乙 | 丙 | 丁 | |
均匀研磨后的石灰石样品质量 |
|
|
|
|
盐酸的质量 |
|
|
|
|
剩余固体的质量 |
|
|
|
|
试问答:
(1)![]() 样品与
样品与![]() 盐酸充分反应后,盐酸是否有剩余______
盐酸充分反应后,盐酸是否有剩余______ ![]() 填“是”或“否”
填“是”或“否”![]() ;样品中碳酸钙的质量分数是______。
;样品中碳酸钙的质量分数是______。
(2)计算所用盐酸的质量分数![]() 写出计算过程
写出计算过程![]()
(3)画出![]() 样品与
样品与![]() 盐酸混合后产生二氧化碳的质量与盐酸的关系图。
盐酸混合后产生二氧化碳的质量与盐酸的关系图。

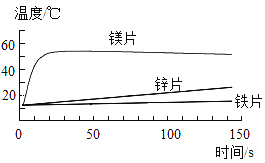
【题目】下列各组物质间能通过一步反应就能实现如图转化的是( )
X | Y | Z | |
A | Fe | FeCl2 | Fe2O3 |
B | O2 | CuO | Cu |
C | AgNO3 | Ba(NO3)2 | BaSO4 |
D | Ca(OH)2 | NaOH | H2O |

A. AB. BC. CD. D