题目内容
实验室用锌和稀硫酸反应制取氢气(反应方程式:Zn+H2SO4═ZnSO4+H2↑),现用6.5g锌与足量稀硫酸反应,求生成氢气的质量是多少?
【考点】根据化学反应方程式的计算.
【专题】有关化学方程式的计算.
【分析】欲正确解答本题,需根据化学方程式得出各物质之间的质量比,列出比例式,通过计算得出生成氢气的质量.
【解答】解:设生成氢气的质量为x,
Zn+H2SO4═ZnSO4+H2↑
65 2
6.5g x


x=0.2g
答:生成氢气的质量为0.2g.
【点评】本题主要考查学生运用化学方程式进行计算的能力.

下列实验设计及操作,其现象足以说明结论的是操作现象结论( )
| 操 作 | 现 象 | 结 论 | |
| A | 在某氢氧化钠溶液样品中,加入足量的氯化钙溶液,过滤,在滤液中滴入2滴酚酞试液 | 出现白色沉淀,酚酞不变红 | 该氢氧化钠溶液一定部分变质 |
| B | 向滴有酚酞的稀氢氧化钠溶液的 | 红色褪去 | 氢氧化钠与盐酸一定发生了反应 |
|
| 将充满二氧化碳气体的试管倒扣 | 试管内液 | 二氧化碳与氢氧化钠一定发生了反应 |
| D | 将浓盐酸和大理石反应放出的气 | 石灰水始 | 该石灰水 |
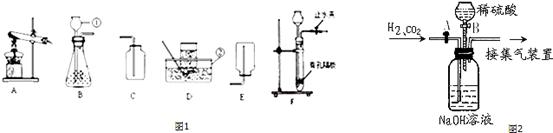
 该混合气体的目的.操作步骤如下:① (填操作),通入混合气体,可收集到 气体.②然后 (填操作),又可收集到另一种气体,写出产生另一种气体的化学方程式 .
该混合气体的目的.操作步骤如下:① (填操作),通入混合气体,可收集到 气体.②然后 (填操作),又可收集到另一种气体,写出产生另一种气体的化学方程式 . C
C