题目内容
实验室常用燃烧的方法测定有机物的组成.现取3.2g某有机物在足量氧气中充分燃烧,生成4.4g二氧化碳和3.6g水,则该有机物中( )
| A.一定含有C、H两种元素,可能含有O元素 |
| B.一定含有C、H、O三种元素 |
| C.只含有C、H两种元素,不含有O元素 |
| D.C、H两种元素质量比为11:9 |
根据质量守恒定律,反应后生成的二氧化碳中碳元素的质量就是有机物中碳元素的质量,生成的水中氢元素的质量就是有机物中氢元素的质量.故该有机物中含有C的质量为:4.4g×
=1.2g;该有机物中含有H的质量为:3.6g×
=0.4g;该有机物中含有O的质量为:3.2g-1.2g-0.4g=1.6g.因此可判断该有机物中含有C、H、O三种元素.
故选B.
| 12 |
| 44 |
| 2 |
| 18 |
故选B.

练习册系列答案
相关题目
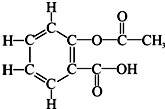 (2010?资阳)阿斯匹林又叫乙酰水杨酸,是人类常用的具有解热和镇痛等作用的一种药物,该药问市已有百多年历史.阿斯匹林的分子结构如图所示.
(2010?资阳)阿斯匹林又叫乙酰水杨酸,是人类常用的具有解热和镇痛等作用的一种药物,该药问市已有百多年历史.阿斯匹林的分子结构如图所示.