题目内容
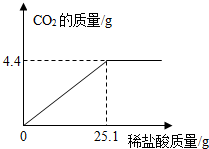 (2013?普宁市模拟)某碱厂的主要产品之一是小苏打(碳酸氢钠),为了测定产品中碳酸氢钠的质量分数(假设该样品中只含氯化钠一种杂质).取样品10.0g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如图所示.(有关反应:NaHCO3+HCl=NaCl+X+CO2↑)求:
(2013?普宁市模拟)某碱厂的主要产品之一是小苏打(碳酸氢钠),为了测定产品中碳酸氢钠的质量分数(假设该样品中只含氯化钠一种杂质).取样品10.0g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如图所示.(有关反应:NaHCO3+HCl=NaCl+X+CO2↑)求:(1)X的化学式为:
H2O
H2O
.(2)样品中碳酸氢钠的质量分数(写出计算过程).
分析:(1)根据质量守恒定律求出X是水;(2)碳酸氢钠与盐酸反应,生成氯化钠、水和二氧化碳;根据质量关系图,当加入25.1稀盐酸时恰好完全反应,放出气体二氧化碳的质量为4.4g;
样品中碳酸氢钠的质量分数=
×100%,因此,需要根据化学方程式,由产生二氧化碳气体的质量计算样品中碳酸氢钠的质量.
样品中碳酸氢钠的质量分数=
| 样品中碳酸氢钠质量 |
| 样品质量10g |
解答:解:(1)根据质量守恒定律可知反应前后各种原子的种类和个数不变,反应物中含有:1个钠原子、2个氢原子、1个碳原子、3个氧原子、1个氯原子,生成物中含有1个钠原子、1个氯原子、1个碳原子、2个氧原子,还少2个氢原子、1个氧原子,所以X化学式是H2O;
设样品中碳酸氢钠的质量为x,
NaHCO3+HCl=NaCl+H2O+CO2↑
84 44
x 4.4g
根据
=
解得x=8.4g
样品中碳酸氢钠的质量分数=
×100%=84%
故答案为:(1)H2O;(2)84%.
设样品中碳酸氢钠的质量为x,
NaHCO3+HCl=NaCl+H2O+CO2↑
84 44
x 4.4g
根据
| 84 |
| 44 |
| x |
| 4.4g |
样品中碳酸氢钠的质量分数=
| 8.4g |
| 10g |
故答案为:(1)H2O;(2)84%.
点评:反应与图象结合类问题,根据图形分析反应的进程是进行答题的基础,图象出现的拐点为恰好完全反应点.

练习册系列答案
相关题目

