题目内容
3.把20g由两种金属粉末组成的混合物投入到足量的稀盐酸中,充分反应后,收集到2g氢气.该混合物的组成可能是( )| A. | Zn、Fe | B. | Mg、Cu | C. | Mg、Fe | D. | Al、Cu |
分析 首先判断金属能否与酸反应,然后从金属与酸反应生成氢气的质量关系考虑.根据化学方程式,可得出如下金属与氢气的质量关系:Mg-H2:24-2,Al-H2,18,2;
Fe-H2:56-2 Zn-H2:64-2;利用平均值法:A 金属的数值<混合物金属的数值<金属B的数值.
解答 解:假设金属味二价能反应金属则设金属为M,其相对原子质量为m.
M+2HCl=MCl2+H2↑
m 2
20g 2g
$\frac{m}{2}$=$\frac{20g}{2g}$
m=20
A、Zn和Fe,65、56,平均大于20,故不可能.
B、Mg和Cu,因为铜不会与酸反应生成氢气,假设只有镁则需65g才能生成2g氢气,大于20g,故不可能.
C、Mg和Fe,24、56,平均大于20,故不可能.
D、Al和Cu,因为铜不会与酸反应生成氢气,假设只有铝则需18g才能生成2g氢气,可能20g,故可能.
故选D.
点评 本题主要考查金属活动性顺序和化学方程式的计算,熟记金属的活动性顺序,掌握有关化学方程式计算的原理和方法,采用平均值法问题就会迎刃而解.

练习册系列答案
相关题目
13.2013年3月,浙江大学实验室里诞生了世界上最轻的材料--“碳海绵”.它具有高弹性和疏松多孔的结构,主要成分是石墨烯和碳纳米管(两者都是碳单质).下列关于“碳海绵”的说法中,正确的是( )
| A. | 常温下化学性质活泼 | B. | 它属于合成材料 | ||
| C. | 在氧气中完全燃烧的产物是CO | D. | 一定条件下可以还原氧化铁 |
14.下列图象能正确反映对应变化关系的是( )
| A. | 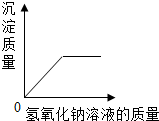 向一定量硫酸铜和硫酸混合液滴入氢氧化钠 | |
| B. | 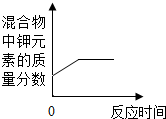 加热一定量氯酸钾 和二氧化锰混合物 | |
| C. | 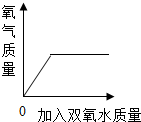 向盛有少量二氧化锰的 烧杯中不断加入双氧水 | |
| D. | 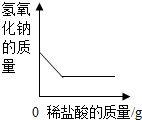 向一定量氢氧化钠溶液中滴入稀盐酸 |
11.下列图象与所对应操作相符的是( )
| A. |  20℃时,把少量氧化钙固体放入饱和氢氧化钙溶液中 | |
| B. |  向两份相等质量、相等溶质质量分数的稀硫酸中,分别加入过量的金属Mg和Al | |
| C. |  用相等质量、相等溶质质量分数的双氧水分别制取O2 | |
| D. |  向稀盐酸和氯化铜的混合溶液中加入过量的NaOH溶液 |
18.实验是学习化学的重要方法,下列做法中能达到实验目的是( )
| A. | 向移动质量的澄清石灰水中通入少量的二氧化碳,可以增加溶液的质量 | |
| B. | 向样品中滴加过量的稀盐酸,再加热,可以除去氯化钠溶液中的碳酸钠 | |
| C. | 取样,加足量水溶解、过滤、蒸发、洗涤、干燥,可以分离氯化钠和氯化银 | |
| D. | 取样,置于两只试管中,分别滴加氯化钡溶液,可以鉴别碳酸钠溶液和硫酸钠溶液 |
15.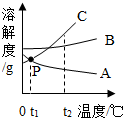 如图为A、B、C三种固体物质的溶解度曲线,下列说法错误的是( )
如图为A、B、C三种固体物质的溶解度曲线,下列说法错误的是( )
 如图为A、B、C三种固体物质的溶解度曲线,下列说法错误的是( )
如图为A、B、C三种固体物质的溶解度曲线,下列说法错误的是( )| A. | A、B、C三种物质的溶解度都随着温度的而升高而增大 | |
| B. | 在t2℃时,C物质的溶解度最大 | |
| C. | 在t1℃时A物质和C物质的溶解度相等 | |
| D. | 根据溶解度曲线图,可得到B物质在某温度下的溶解度 |
8. 食品包装袋中常用脱氧剂.某化学兴趣小组将脱氧剂封口打开,将其倒在滤纸上,
食品包装袋中常用脱氧剂.某化学兴趣小组将脱氧剂封口打开,将其倒在滤纸上,
观察到脱氧剂大部分为黑色粉末,其中还夹杂着少量红色粉末.
【提出问题】该脱氧剂中的黑色、红色粉末各是什么?
【提出猜想】黑色粉末可能含炭粉、铁粉、氧化铜中的一种或几种.红色粉末可能含有氧化铁、铜粉中的一种或几种.
【进行实验】
【得出结论】由实验①②可知,脱氧剂中黑色粉末肯定含铁粉、碳粉.脱氧剂中的红色粉末肯定不含铜,肯定含氧化铁,写出相应的化学方程式Fe2O3+3H2SO4═Fe2(SO4)3+3H2O.
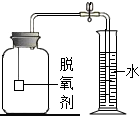
【拓展延伸】小明认为铁生锈时会消耗氧气,因此可用此脱氧剂(实验室可滴几滴水)测定空气中氧气的含量,装置如右图所示.集气瓶的实际容积是150mL,量筒内盛100mL的水.当量筒内水面不再变化,且温度回复至室温时,读出水面在73mL刻度处.由上述实验数据可以算出,空气中氧气的体积分数是18%.本实验的测量结果与理论值不一致,原因可能是脱氧剂不足.
 食品包装袋中常用脱氧剂.某化学兴趣小组将脱氧剂封口打开,将其倒在滤纸上,
食品包装袋中常用脱氧剂.某化学兴趣小组将脱氧剂封口打开,将其倒在滤纸上,观察到脱氧剂大部分为黑色粉末,其中还夹杂着少量红色粉末.
【提出问题】该脱氧剂中的黑色、红色粉末各是什么?
【提出猜想】黑色粉末可能含炭粉、铁粉、氧化铜中的一种或几种.红色粉末可能含有氧化铁、铜粉中的一种或几种.
【进行实验】
| 实验编号 | 实验操作 | 实验现象 |
| ① | 取脱氧剂粉末加入足量稀硫酸 | 粉末几乎全部溶解,只有少量黑色粉末未溶解,有气泡产生,溶液变成黄色 |
| ② | 取实验①的残渣灼烧,将内壁有 澄清石灰水的小烧杯罩在上方 | 澄清石灰水变浑浊 |
【拓展延伸】小明认为铁生锈时会消耗氧气,因此可用此脱氧剂(实验室可滴几滴水)测定空气中氧气的含量,装置如右图所示.集气瓶的实际容积是150mL,量筒内盛100mL的水.当量筒内水面不再变化,且温度回复至室温时,读出水面在73mL刻度处.由上述实验数据可以算出,空气中氧气的体积分数是18%.本实验的测量结果与理论值不一致,原因可能是脱氧剂不足.