题目内容
3. 如图所示是化学试剂瓶上的标签,取10mL该硫酸可配制成9.8%的稀硫酸质量为184g,配制9.8%的稀硫酸的操作是用量筒量取浓硫酸和水,把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌;完全中和稀硫酸需要氢氧化钠的质量为mg,若用mg氢氧化钾与上述稀硫酸充分反应,所得溶液的pH小于7(填“大于”、“小于”或“等于”).
如图所示是化学试剂瓶上的标签,取10mL该硫酸可配制成9.8%的稀硫酸质量为184g,配制9.8%的稀硫酸的操作是用量筒量取浓硫酸和水,把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌;完全中和稀硫酸需要氢氧化钠的质量为mg,若用mg氢氧化钾与上述稀硫酸充分反应,所得溶液的pH小于7(填“大于”、“小于”或“等于”).
分析 根据溶液稀释前后溶质的质量不变,结合题意、浓硫酸的稀释方法,进行分析解答.
根据氢氧化钠、氢氧化钾分别与稀硫酸反应的化学方程式,判断完全反应后剩余的是哪一种溶液,再根据当溶液的pH等于7时,呈中性;当溶液的pH小于7时,呈酸性;当溶液的pH大于7时,呈碱性,进行分析解答.
解答 解:10mL=10cm3.
设可配制成9.8%的稀硫酸质量为x,根据溶液稀释前后溶质的质量不变,
则1.84g/cm3×10cm3×98%=x×9.8% x=184g.
接下来所要进行的操作是量取浓硫酸和水,再进行混匀,稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散.
2NaOH+H2SO4═Na2SO4+2H2O
80 98
2KOH+H2SO4═K2SO4+2H2O
112 98
由氢氧化钠、氢氧化钾与硫酸反应的质量关系,与等质量的硫酸反应,消耗的氢氧化钾的质量比消耗的氢氧化钠的质量多,则完全中和稀硫酸需要氢氧化钠的质量为mg,若用mg氢氧化钾与上述稀硫酸充分反应,则稀硫酸有剩余,所得溶液显酸性,反应后溶液pH值小于7.
故答案为:184;用量筒量取浓硫酸和水,把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌;小于.
点评 本题难度不大,掌握溶液稀释前后溶质的质量不变、利用化学方程式的计算判断出反应后剩余的物质等是正确解答本题的关键.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目
11. 甲、乙、丙和X、Y、Z都是初中化学中常见的物质,甲、乙、丙都是氧化物,且常温下甲固体,乙是气体,丙是液体.在一定条件下,甲、乙、丙之间存在如图所示的转化关系(反应条件和部分生成物已略去).下列判断正确的是( )
甲、乙、丙和X、Y、Z都是初中化学中常见的物质,甲、乙、丙都是氧化物,且常温下甲固体,乙是气体,丙是液体.在一定条件下,甲、乙、丙之间存在如图所示的转化关系(反应条件和部分生成物已略去).下列判断正确的是( )
 甲、乙、丙和X、Y、Z都是初中化学中常见的物质,甲、乙、丙都是氧化物,且常温下甲固体,乙是气体,丙是液体.在一定条件下,甲、乙、丙之间存在如图所示的转化关系(反应条件和部分生成物已略去).下列判断正确的是( )
甲、乙、丙和X、Y、Z都是初中化学中常见的物质,甲、乙、丙都是氧化物,且常温下甲固体,乙是气体,丙是液体.在一定条件下,甲、乙、丙之间存在如图所示的转化关系(反应条件和部分生成物已略去).下列判断正确的是( )| A. | 甲一定是CuO | B. | X一定具有还原性 | ||
| C. | Z一定是酸 | D. | Y和Z一定能发生反应 |
14.图1所示装置可用于测定空气中氧气的含量,其中与集气瓶相连的压强传感器等电子设备能将集气瓶内气体压强精确地记录并保存下来.图2、图3是用该装置测得的红磷和木炭分别在集气瓶中燃烧的压强-时间关系图(该装置气密性良好,p0是集气瓶内初始气压,p和p′分别是反应结束后恢复到室温时集气瓶内的气压).下列说法正确的是( )
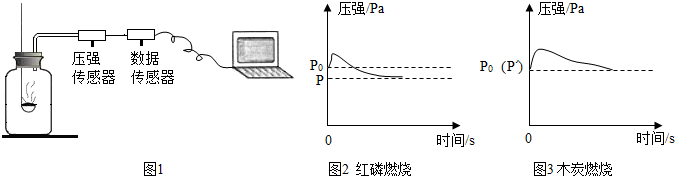

| A. | 燃烧匙内所装红磷或木炭的多少对实验结果无影响 | |
| B. | 反应开始时集气瓶中压强瞬间变大的是由燃烧放热造成的 | |
| C. | p=0.79p0,p′=p0是因为红磷的着火点比木炭低 | |
| D. | 由图3可推出空气中氧气的含量 |
11.要将KCl、MgCl2和BaSO4的固体混合物逐一分离开来,加入的试剂及顺序正确的是( )
| A. | 水、AgNO3溶液、稀硝酸 | B. | 水、NaOH溶液、稀盐酸 | ||
| C. | 水、KOH溶液、稀盐酸 | D. | 水、KOH溶液、稀硫酸 |
18.下列图示的实验操作正确的是( )
| A. |  称量一定量的氯化钠 | B. |  将铁粉装入试管中 | ||
| C. |  量取9.3mL浓硫酸 | D. |  加热液体 |
13.在已经调平的托盘天平两边各放一只等质量的烧杯,向烧杯中各加入质量相等.溶质质量分数相同的稀盐酸,然后在左边烧杯中放入镁,在右边的烧杯中放入与镁质量相等的铝.待充分反应后,下列分析错误的是( )
| A. | 天平保持平衡,左边烧杯中,酸没有剩余,镁可能有剩余 | |
| B. | 天平保持平衡,右边烧杯中,酸没有剩余,铝一定有剩余 | |
| C. | 天平失去平衡,左边烧杯中,酸一定剩余,镁一定没剩余 | |
| D. | 天平失去平衡,右边烧杯中,酸可能剩余,铝一定没剩余 |

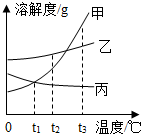 如是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线.
如是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线.