题目内容
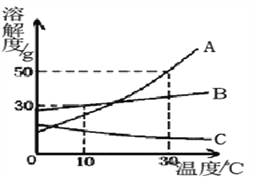
【题目】氯化钠和硫酸镁的溶解度曲线与若干温度下的溶解度表如下:
温度/℃ | 20 | 30 | 40 | 60 | 80 | 90 | 100 | |
溶解度 (g/100GH20) | NaCl | 36.0 | 36.3 | 36.6 | 37.3 | 38.4 | 39.0 | 39.8 |
MgSO4 | 33.7 | 38.9 | 44.5 | 54.6 | 55.8 | 52.9 | 50.4 | |

请回答下列问题:
(1)80℃时,硫酸镁的溶解度为__________,溶解度曲线甲所代表的物质是__________。a点对应的温度t1范围是____________________。
(2)t2℃时有含有较多NaCl 的MgSO4溶液,为了得到纯净的MgSO4,可采用的方法__________
(3)40℃时把20g NaCl放入50g水中,形成的溶液中溶质质量分数为__________(精确到0.1%),要使t3℃饱和的MgSO4溶液中溶质质量分数增大,可采用的措施是__________。
【答案】 55.8g 氯化钠 20°C<t1<30°C 降温结晶 过滤析出的晶体 洗涤、烘干 26.8% 适当降温并加入MgSO4固体
【解析】(1)由溶解度表可知,80℃时,硫酸镁的溶解度为55.8g,从溶解度曲线可知,甲所代表的物质溶解度随温度的升高而增大,故甲是氯化钠。a点表示在某一温度时,氯化钠与硫酸镁的溶解度相等,根据溶解度表可知,两种物质溶解度相等对应的温度范围是20°C<t1<30°C。(2)由溶解度曲线看出,在0°C~t2℃范围内,硫酸镁的溶解度随温度的升高而增大,且受温度影响较大,而氯化钠的溶解度受温度影响不大,所以为了得到纯净的MgSO4,可用降温结晶法,然后将过滤析出的晶体洗涤、烘干。(3)40℃时,氯化钠的溶解度是36.6g,50g水中最多能溶解 18.3g氯化钠,所以把20g NaCl放入50g水中,形成的溶液中溶质质量分数为:![]() ×100%=26.8%。由t3℃时降温,硫酸镁的溶解度增大,所以要使t3℃饱和的MgSO4溶液中溶质质量分数增大,可采用的措施是适当降温并加入MgSO4固体。
×100%=26.8%。由t3℃时降温,硫酸镁的溶解度增大,所以要使t3℃饱和的MgSO4溶液中溶质质量分数增大,可采用的措施是适当降温并加入MgSO4固体。

【题目】马英同学取某地石灰石样品12 g进行测定实验,现将100 g稀盐酸分五次加入石灰石样品中(杂质不溶于水也不参与反应),充分反应后测得生成气体的总质量如表所示:
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加入稀盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
生成气体的总质量/g | 1.1 | 2.2 | m | 4.4 | 4.4 |
试求:
(1)m的值为________g。
(2)石灰石样品中碳酸钙的质量分数______。(写出计算过程,计算结果精确至0.1%)
【题目】某同学在实验室通过实验对草酸进行如下研究。
【查阅资料】①无水硫酸铜吸水后由白色变为蓝色
②氯化钯(PdCl2)溶液遇CO产生黑色沉淀
【实验准备】选用下列实验装置(气密性良好,部分固定装置已略去):
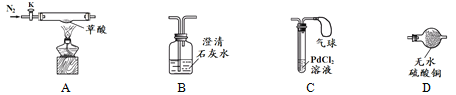
【实验探究】检验草酸分解的产物。
实验步骤 | 实验现象 | 实验结论及分析 |
(1)按A→D→B→C连接仪器 (2)关闭K,点燃A处酒精灯 | D中_________________B中澄清石灰水变浑浊C中产生黑色沉淀,气球鼓起 | 草酸分解生成了CO2、CO和H2O B中反应的化学方程式是:_______________________ ②C中气球的作用是__________ |