题目内容
19.如图中A、B、C、D是四种粒子的结构示意图,请回答下列问题:
(1)A中x=2;
(2)B与C形成化合物的化学式是Al2O3;
(3)以上四种结构示意图所表示的粒子中,表示离子的是AD(填字母代号)
分析 (1)根据原子核外电子排布规律及原子中质子数=核外电子数,进行计算解答;
(2)先判断B与C元素种类,再根据化学式的书写原则书写即可;
(3)根据阴离子的质子数<电子数,阳离子的质子数>电子数来分析解答.
解答 解:
(1)根据原子核外电子排布规律结合图形可知:第一层为2个电子,故x=2
(2)有图可知:B与C分别为铝元素、氧元素,铝原子易失去3个电子从而铝元素显+3价,氧原子易得到2个电子,氧元素显-2价,故它们形成化合物的化学式是Al2O3;
(3)A中的质子数=16<电子数=18,故为阴离子;D中的质子数=9<电子数=10,故为阴离子.
故答案为:
(1)2;(2)Al2O3;(3)AD.
点评 本题难度不大,考查学生对粒子结构示意图及其意义的理解,了解粒子结构示意图的意义、化学式的书写等知识是正确解题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.如图是“尾气催化转换器”将汽车尾气中有毒气体转变为无毒气体的微观示意图,下列说法正确的是( )


| A. | 该反应是置换反应 | B. | 生成的两种分子个数比为1:1 | ||
| C. | 反应中有元素化合价发生改变 | D. | 原子在化学变化中可以再分 |
4.下列有关物质的分类不正确的是( )
| 选项 | 物质 | 分类 |
| A | 水、二氧化硫、一氧化碳 | 氧化物 |
| B | 煤、石油、天然气 | 化石燃料 |
| C | 氢气、碳、一氧化碳 | 具有还原性的单质 |
| D | 二氧化碳、臭氧、甲烷 | 能产生温室效应的气体 |
| A. | A | B. | B | C. | C | D. | D |
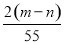 B.
B.  C.
C.  D.
D. 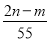


 如图所示是2015年8月12日天津港火灾爆炸事故现场,事故的直接原因是集装箱内硝化棉由于湿润剂散失出现局部干燥,在高温(天气)等因素的作用下加速分解放热,积热自燃,导致堆放于相邻位置的硝酸铵等危险化学品发生爆炸.硝酸铵在400℃以上时剧烈分解、发生爆炸,其化学方程式如下:4NH4NO3═3N2+2NO2+8X.请回答下列问题.
如图所示是2015年8月12日天津港火灾爆炸事故现场,事故的直接原因是集装箱内硝化棉由于湿润剂散失出现局部干燥,在高温(天气)等因素的作用下加速分解放热,积热自燃,导致堆放于相邻位置的硝酸铵等危险化学品发生爆炸.硝酸铵在400℃以上时剧烈分解、发生爆炸,其化学方程式如下:4NH4NO3═3N2+2NO2+8X.请回答下列问题.