题目内容
取一定质量的CO和CO2的混合气体,通入到足量的Ba(OH)2溶液中,充分反应后过滤,测得生成的沉淀和所取的混合气体的总质量相等.则原混合气体中碳原子和氧原子的个数比为( )
| A.1:1 | B.2:3 | C.153:28 | D.181:209 |
设CO2的质量为44克,根据化学方程式CO2+Ba(OH)2=BaCO3↓+H2O,解得BaCO3质量为197克,即CO2和CO质量和为197克,故CO质量为197g-44g=153克;
n(CO2)=
=
=1mol,
所以CO2中n(C)=1mol,n(O)=2mol;
n(CO)=
=
=
mol,
所以CO中n(C)=
mol,n(O)=
mol;
所以混合气体中碳原子和氧原子的个数比=n(C)总:n(O)总=(1mol+
mol):(2mol+
mol)=181:209.
故选D.
n(CO2)=
| m(CO2) |
| M(CO2) |
| 44g |
| 44g/mol |
所以CO2中n(C)=1mol,n(O)=2mol;
n(CO)=
| m(CO) |
| M(CO) |
| 153g |
| 28g/mol |
| 153 |
| 28 |
所以CO中n(C)=
| 153 |
| 28 |
| 153 |
| 28 |
所以混合气体中碳原子和氧原子的个数比=n(C)总:n(O)总=(1mol+
| 153 |
| 28 |
| 153 |
| 28 |
故选D.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
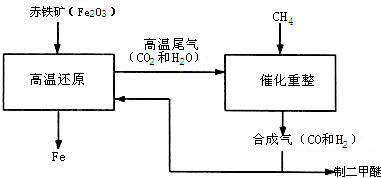
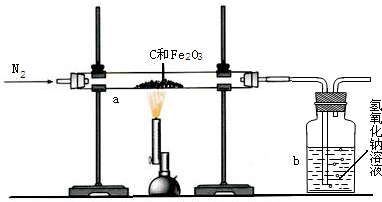
 某研究性学习小组设计并进行了如下实验.
某研究性学习小组设计并进行了如下实验.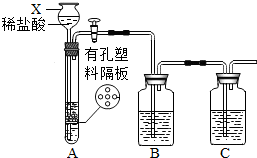 某研究性学习小组设计并进行了如下实验.
某研究性学习小组设计并进行了如下实验.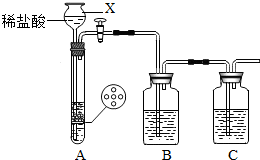 (2012?崇川区一模)某研究性学习小组设计并进行了如下实验.
(2012?崇川区一模)某研究性学习小组设计并进行了如下实验. 某研究性学习小组设计并进行了如下实验.
某研究性学习小组设计并进行了如下实验.