题目内容
15.金属以及合金有广泛的用途.(1)一角硬币为铝合金或或不锈钢制作,选择铸币的材料时不需要考虑的因素是A.
A.金属的导电性 B.金属的耐磨性
C.金属的硬度 D.金属价格与硬币面积的吻合度
(2)铝具有很好的抗腐蚀性能的原因是(用化学方程式表示)4Al+3O2=2Al2O3;而金属铁则很容易生锈,铁生锈的主要条件是氧气、水.
(3)下图为某学习小组探究金属化学性质时所做的四个实验,请回答.

②较C、D中产生气泡的剧烈程度(盐酸浓度相同),C(填序号)较剧烈.
②写出B中反应的化学方程式Fe+CuSO4═FeSO4+Cu.
③描述A中的实验现象铜丝表面附着一层银白色固体,溶液变为蓝色.
④要证明Cu、Fe、Ag的活动性顺序,至少要做的实验是AB(填序号).
(4)铜以及铜合金的应用,在我们安阳有着厚重的历史.现有黄铜(铜、锌合金)10g,与足量的稀硫酸完全反应后,测得剩余固体的质量为6.75g.请计算生成氢气的质量.
分析 (1)根据硬币的流通特点分析硬币应具有的特点要求,特别是其耐腐蚀、硬度、及价值的相关因素;
(2)根据铝在空气容易形成致密的氧化物,因此抗腐蚀性能很好;金属铁的锈蚀条件:铁与氧气、水同时接触就会生锈,进行解答;
(3)在金属活动性顺序中,只有排在氢前的金属可以和稀酸溶液(除稀硝酸外)生成氢气,只有前面的金属可以把排在它后面的金属从盐溶液中置换出来,利用这一规律对问题进行判断分析即可;
(4)由于黄铜中锌与稀盐酸反应放出氢气,铜与盐酸不反应,所以恰好完全反应后过滤得到的滤渣是铜,进而可计算锌的质量,据方程式计算出生成氢气的质量.
解答 解:(1)根据硬币的流通特点可知:铸造出的硬币要有较强的耐腐蚀性、硬度较大且硬币价值与面值的吻合度要接近,而金属的导电性不是铸造硬币所考虑的因素;故选A.
(2)根据铝在空气容易形成致密的氧化物,所以铝在空气中具有很好的抗腐蚀性能的原因是:铝与空气中的氧气反应,表面形成致密的氧化铝薄膜;其化学方程式为4Al+3O2=2Al2O3;金属铁的锈蚀条件:铁与氧气、水同时接触就会生锈.
(3)①因为锌的活动性较强,故较C、D中产生气泡的剧烈程度(盐酸浓度相同),C中较剧烈.
②B中为铁与硫酸铜溶液反应,故其反应的化学方程式为Fe+CuSO4═FeSO4+Cu.
③由于在金属活动性顺序中铜>银,所以铜可以置换出银,并生成蓝色的硫酸铜溶液,所以A中的实验现象是铜丝表面附着一层银白色固体,溶液变为蓝色;
④用于证明铁、铜、银的金属活动性顺序实验是A、B,因为由A知铜能置换出硝酸银中的银,说明活动性铜>银,B中的铁能置换出硫酸铜中的铜,说明活动性铁>铜,所以可得活动性:铁>铜>银;
(4)解:(1)黄铜中锌与稀盐酸反应放出氢气,铜与盐酸不反应,所以恰好完全反应后过滤得到的滤渣是铜,则黄铜中锌的质量是10g-6.75g=3.25g;
设反应产生氢气的质量为x.
Zn+2HCl=ZnCl2+H2↑
65 2
3.25g x
则$\frac{65}{2}=\frac{3.25g}{x}$,解得x=0.1g.
故反应产生氢气的质量是0.1g;
故答案为:
(1)A.(2)4Al+3O2=2Al2O3; 氧气、水.
(3)①C.②Fe+CuSO4═FeSO4+Cu.③铜丝表面附着一层银白色固体,溶液变为蓝色.④AB.(4)0.1g.
点评 此题是一道与金属相关的考查题,解题的关键是充分理解和掌握金属和合金的性质以及其它相关的知识.

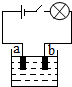 小李同学查阅资料了解到化合物根据导电性的不同,可分为电解质和非电解质两大类.其中在水溶液里或熔化状态下能够导电的化合物叫做电解质,在水溶液里或熔化状态下都不能导电的化合物叫做非电解质.于是他以食盐、硝酸钾、蔗糖、氢氧化钠和硫酸铜为材料,按如图所示的装置进行实验,实验结果记录如表:
小李同学查阅资料了解到化合物根据导电性的不同,可分为电解质和非电解质两大类.其中在水溶液里或熔化状态下能够导电的化合物叫做电解质,在水溶液里或熔化状态下都不能导电的化合物叫做非电解质.于是他以食盐、硝酸钾、蔗糖、氢氧化钠和硫酸铜为材料,按如图所示的装置进行实验,实验结果记录如表:| 物质 导电性 状态 | 食盐 NaCL | 硝酸钾 KNO3 | 蔗糖 C12H22O11 | 氢氧化钠 NaOH | 硫酸铜 CuSO4 |
| 固态 | × | × | × | × | × |
| 溶化状态 | √ | √ | × | √ | √ |
| 水溶液 | √ | √ | × | √ | √ |
(2)老师告诉小李同学,用上述装置实验,电解质溶液在导电的同时,在电极a、电极b上都会有新的物质生成.据此判断,这是一种将电能转变为化学 能的装置.
(3)阅资料得知,电解质能导电,是由于在水溶液里或熔化状态下产生自由移动的离子,这
些阴、阳离子在电流的作用下定向移动.如氯化钠在水溶液里会产生能自由移动的Na+和
Cl-,当闭合开关后,Cl-离子会由b向a方向移动.
(4)进一步查阅资料得知,一定量溶液中的阴、阳离子越多,溶液的导电性就越好.据此判断,当闭合开关后,向盛有硫酸铜溶液的烧杯中持续滴加氢氧化钡溶液时,灯泡的亮度会如何变化?先变暗直至熄灭后逐渐变亮.

(1)仪器a的名称是试管;搭建B装置时,酒精灯应在固定仪器a之前(选填“前”或“后”)放置;
(2)选择不同的药品和实验装置可以制取O2,请填写下表:
| 选用药品 | 发生装置(填序号) | 收集装置(填序号) | 反应原理(化学方程式) |
| 过氧化氢溶液 二氧化锰 | ① | ③ | ④ |
| 高锰酸钾 | ② | ⑤ |
| 药品 | 甲 | 乙 | 丙 | 丁 |
| 大理石 | mg块状 | Mg块状 | Mg粉末状 | Mg粉末状 |
| 盐酸(过量) | Wg稀盐酸 | Wg浓盐酸 | Wg稀盐酸 | Wg浓盐酸 |
Ⅱ.若要研究盐酸浓度大小对反应的影响,可选实验甲与乙对照(选填实验编号)
Ⅲ.除盐酸的浓度外,上述实验研究的另一个影响反应的因素是反应物的接触面积;
Ⅳ.研究发现酸浓度越大,产生气体速度越快,与甲比较,对丁分析正确的是A、B(选填编号)
A.反应更为剧烈 B.最终剩余溶液的质量更小
C.产生的二氧化碳的质量更大 D.粉末状大理石利用率更高.
| A. | 煤炉旁放一盆水就能防止一氧化碳中毒 | |
| B. | 扑灭电器、图书、档案等火灾,最适宜的灭火器是二氧化碳灭火器 | |
| C. | 一氧化碳能使紫色石蕊试液变红色 | |
| D. | 红磷燃烧呈蓝色火焰,冒大量白烟 |
(2)进入北京海淀区西部的京密引水渠是向北京市供水的重要通道.为了保护好城市用水,下列做法中,不正确的是①②④(填写序号);
①在引水渠岸边堆放垃圾 ②向引水渠中排放工业废水
③在引水渠两岸植树 ④向引水渠中倾倒生活污水
(3)资料一:我国部分省市人均水量图

资料二:水资源紧缺指标
| 紧 缺 性 | 轻度缺水 | 中度缺水 | 重度缺水 | 极度缺水 |
| 人均水量(m3/α) | 1700-3000 | 1000-1700 | 500-1000 | <500 |
资料三:如图二是某些国家的人均水量和世界人均水量(m3/人).
(1)由图中可以看出我国是一个水资源短缺的国家.
(2)研究表明,一节含汞、镉、铅等金属的电池所造成的污染可使60t水无法使用.若成年人每人每天饮水约2kg,则60t水能供一个人饮用约82年.(一年按365天计)
(3)某同学向政府提出了几条建议:①向河中放养鱼苗,保持生态平衡②清理南桥河中的污泥③禁止向河道内倾倒垃圾 ④禁止使用化肥和农药,防止水质污染其中不合理的是④.(填序号)
(4)谈谈你在生活中节约用水的三点做法洗手时随时关闭水龙头、用洗衣水冲厕、用淘米的水浇花.
| 次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸质量/g | 70 | 70 | 70 | 70 |
| 剩余固体质量/g | 18.2 | 16.4 | 14.6 | 13.2 |
(2)所加稀硫酸中溶质的质量分数.
