题目内容
2.请回答下列有关金属材料的问题:(1)铝具有很好的抗腐蚀性能,其原因是4Al+3O2═2Al2O3(用化学方程式表示).
(2)下列是与铁的性质有关的部分实验图:
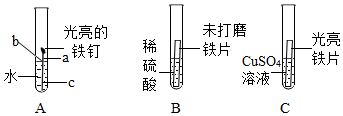
①A中铁钉最易生锈的部位是b(填“a”或“b”或“c”).
②B中刚开始无气泡产生,溶液颜色逐渐由无色变为黄色,此时试管内发生反应的化学方程式是Fe2O3+3H2SO4=Fe2(SO4)3+3H2O.
③C中反应一段时间后,试管内溶液质量比反应前减小(填“增大”或“不变”或“减小”).
(3)铜与另一种金属M的混合物(M可能是Al或Fe或Ag),在该混合物中加入足量的稀硫酸后有气泡产生,待反应完成后过滤,得到滤渣和滤液,在滤液中加入锌片,锌片表面无任何变化,则M是Al,取一定量的原混合物投入到一定量的AgNO3溶液中,充分反应后过滤,对所得溶液和固体推断正确的是AC.
A、溶液中一定有M的离子 B、固体中一定有Ag和Cu
C、固体中一定有Ag D、溶液中一定有Ag+.
分析 (1)首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可.
(2)①根据铁生锈的条件进行分析;
②根据未打磨的铁片表面含有锈,结合实验的现象写出反应的方程式进行分析;
③根据铁和硫酸铜反应生成硫酸亚铁和铜,以及质量守恒定律分析溶液质量的变化.
(3)根据金属与酸反应的规律,由金属粉末与稀硫酸反应,有气泡产生,推断金属M;根据金属与盐反应规律,由锌片表面无任何变化,推断金属M;根据金属和盐溶液反应的规律分析滤液和滤渣的成分.
解答 解:
(1)铝能与空气中氧气反应在其表面生成一层致密的氧化铝薄膜,防止内部的铝进一步被氧化,因此铝制品抗腐蚀性强,反应的化学方程式为:4Al+3O2═2Al2O3.
(2)①铁生锈的条件:铁与水和氧气同时接触,所以因b处与水和氧气同时充分接触,所以最易生锈;
②未打磨的铁片表面含有锈,锈与硫酸反应产生硫酸铁是黄色的溶液,化学方程式为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
③铁和硫酸铜反应产生硫酸亚铁和铜,化学方程式为:Fe+CuSO4=Cu+FeSO4,试管内固体质量比反应前增大,根据质量守恒定律,试管内溶液质量与反应前相比减小.
(3)铜与另一种金属M的混合粉末能与稀硫酸反应放出氢气,可判断金属M能与酸反应产生氢气,因此金属M不可能是金属银;
待反应完成后过滤,得到滤渣和滤液,在滤液中加入锌片,锌片表面无任何变化,可判断盐中金属活动性比锌强,而金属铝的活动性比锌强,因此金属M应为铝;
金属混合物铝和铜的活动性比银强,因此都会发生置换反应,活动性强的铝先和硝酸银反应置换出银,得到硝酸亚铁溶液;铁反应完,若还有硝酸银剩余,则铜会和硝酸银反应,
A、溶液中一定有铁的离子,故A正确;
B、固体中一定含有银,但不一定含有铜,故B错误;
C、固体中一定含有被置换出的银,故C正确;
D、溶液中的硝酸银若完全被置换,则没有银离子,故D错误;
故选项为:AC.
答案:
(1)4Al+3O2=2Al2O3
(2)①b; ②Fe2O3+3H2SO4=Fe2(SO4)3+3H2O; ③减小.
(3)Al; AC.
点评 本题难度不大,考查学生根据反应原理书写化学方程式的能力,生锈的条件、除锈的原理及相关的化学性质,考查的比较全面,难度不大,依据相关的知识分析即可.

 阅读快车系列答案
阅读快车系列答案| A.物质的性质和用途 | B.安全常识 |
| N2化学性质稳定-填充食品袋 乙醇具有可燃性-用作燃料 CO具有还原性-冶炼金属 | 居室装修-常开窗通风,防甲醛中毒 浓硫酸沾到皮肤上-用氢氧化钠溶液中和 煤气泄漏-关闭气阀,严禁烟火 |
| C.实验记录 | D.日常生活经验 |
| 用10ml量筒量取7.25ml水 用托盘天平称取5.6g铁粉 电解水得到氢气和氧气的体积比为2:1 | 焙制高点、蒸馒头-常加入发酵粉 区别矿泉水与蒸馏水-蒸干、看有无固体出现 区分羊毛纤维与合成纤维-灼烧后闻气味 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 竹筷子 | B. | 塑料盆 | C. | 棉毛巾 | D. | 不锈钢锅 |
| A. | 水电解生成氢气和氧气,说明水中含有氢分子和氧分子 | |
| B. | 用肥皂水可以区分硬水和软水 | |
| C. | 过滤能除去天然水中所有的杂质 | |
| D. | 长期饮用蒸馏水对人体健康有利 |

 某同学对实验室制取CO2的实验进行探究.
某同学对实验室制取CO2的实验进行探究. 2016年底,沪昆高铁和云桂高铁开通,使人们的出行更加方便、快捷,结合所学化学知识,回答下列问题:(1)动车中的导线大部分是铜制的,铜属于金属材料,动车大量使用合金,原因是合金的硬度大,抗腐蚀性好等;
2016年底,沪昆高铁和云桂高铁开通,使人们的出行更加方便、快捷,结合所学化学知识,回答下列问题:(1)动车中的导线大部分是铜制的,铜属于金属材料,动车大量使用合金,原因是合金的硬度大,抗腐蚀性好等;