题目内容
将铜和氧化铜固体混合物粉末11.2g放入烧杯中,当加入稀硫酸100 g时,氧化铜与硫酸恰好完全反应.过滤后所得溶液的质量为108g,(不考虑过滤过程中溶液的质量损失).
(1)混合物中铜元素的质量分数为______(计算结果保留到0.1%)
(2)求稀硫酸中H2SO4的质量分数.(写出计算过程)
(1)混合物中铜元素的质量分数为______(计算结果保留到0.1%)
(2)求稀硫酸中H2SO4的质量分数.(写出计算过程)
(1)混合物中铜的质量为
11.2g+100g-108g=3.2g
混合物中氧化铜的质量为
11.2g-3.2g=8g
氧化铜中铜元素的质量为
8g×(
×100%)=6.4g
混合物中铜元素的质量分数为
×100%≈85.7%
(2)设稀硫酸中溶质的质量分数为x.
CuO+H2SO4=CuSO4+H2O
80 98
8g 100g×x
=
,x=9.8%
答:(1)混合物中铜元素的质量分数为85.7%.
(2)稀硫酸中溶质的质量分数为9.8%.
11.2g+100g-108g=3.2g
混合物中氧化铜的质量为
11.2g-3.2g=8g
氧化铜中铜元素的质量为
8g×(
| 64 |
| 80 |
混合物中铜元素的质量分数为
| 3.2g+6.4g |
| 11.2g |
(2)设稀硫酸中溶质的质量分数为x.
CuO+H2SO4=CuSO4+H2O
80 98
8g 100g×x
| 80 |
| 98 |
| 8g |
| 100g×x |
答:(1)混合物中铜元素的质量分数为85.7%.
(2)稀硫酸中溶质的质量分数为9.8%.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 类比法是化学研究物质的重要方法之一.草酸的化学性质与碳酸相似.已知碳酸易分解,草酸在受热条件下也分解,仅生成三种氧化物.某校研究性学习小组对此展开探究:
类比法是化学研究物质的重要方法之一.草酸的化学性质与碳酸相似.已知碳酸易分解,草酸在受热条件下也分解,仅生成三种氧化物.某校研究性学习小组对此展开探究: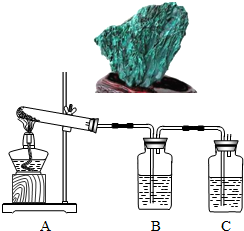 (2012?大兴区二模)孔雀石主要成分是碱式碳酸铜[Cu2(OH)2CO3],绿色并具有浓淡的条状花纹(见右图),是矿物中最吸引人的装饰材料之一,也是人类最早冶炼铜的原料.某校课外小组同学欲在实验室验证碱式碳酸铜制铜的反应原理.
(2012?大兴区二模)孔雀石主要成分是碱式碳酸铜[Cu2(OH)2CO3],绿色并具有浓淡的条状花纹(见右图),是矿物中最吸引人的装饰材料之一,也是人类最早冶炼铜的原料.某校课外小组同学欲在实验室验证碱式碳酸铜制铜的反应原理. 类比法是化学研究物质的重要方法之一.草酸的化学性质与碳酸相似.已知碳酸易分解,草酸在受热条件下也分解,仅生成三种氧化物.某校研究性学习小组对此展开探究:
类比法是化学研究物质的重要方法之一.草酸的化学性质与碳酸相似.已知碳酸易分解,草酸在受热条件下也分解,仅生成三种氧化物.某校研究性学习小组对此展开探究:
