题目内容
19.由FeSO4和FeS组成的混合物中,测知硫元素的质量分数为32%,若再计算混合物中的下列各项:①铁元素的质量分数 ②氧元素的质量分数 ③FeSO4的质量分数 ④FeSO4和FeS的质量比 ⑤FeS的质量,以下判断正确的是( )| A. | 都能确定 | B. | 都不能确定 | C. | 只有①②能确定 | D. | 只有⑤不能确定 |
分析 根据所给物质的化学式进行分析,可以发现,在这两种物质中,铁元素与硫元素的原子个数比都为1:1,也就是铁元素和硫元素的质量比是定值,等于56:32=7:4,根据氧元素的质量分数来确定硫元素的质量分数以及钠元素和钙元素的质量分数.
解答 解:因为在FeSO4和FeS中,铁元素和硫元素的质量比是定值,等于56:32=7:4;由于元素质量比与元素质量分数之比是相等的,设铁元素的质量分数为x,则
7:4=x:32%,解得x=56%,即铁元素的质量分数为56%;氧元素的质量分数=1-32%-56%=12%;
假设混合物的质量为100g,设FeSO4的质量为x,则FeS的质量为100g-x,
FeSO4中硫元素的质量分数为:$\frac{32}{56+32+64}×100%$≈21.1%;
FeS中氧元素的质量分数为:$\frac{32}{56+32}×100%$≈36.4%.
∴21.1%x+36.4%×(100g-x)=100g×32%,
x=28.5g
则FeS的质量为:100g-28.5g=71.5g.
则FeSO4和FeS的质量比为:28.5g:71.5g=57:143;
混合物中FeSO4的质量分数为:$\frac{28.5g}{100g}×100%$=28.5%;
因为题目未告知混合物的总质量,因此不能确FeS的具体质量.
故选D.
点评 本题主要考查学生灵活运用元素的质量分数公式进行计算的能力.难度稍大.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
7.绿原酸(C16H18O9)被誉为“第七类营养素”,它可以从栽种较广的杜仲中提取.下列有关绿原酸的说法错误的是( )
| A. | 绿原酸由碳元素、氢元素、氧元素组成的 | |
| B. | 该绿原酸中氢元素的质量分数最小 | |
| C. | 绿原酸分子中含有16个碳原子、18个氢原子、9个氧原子 | |
| D. | 绿原酸(C16H18O9)相对分子质量为354 |
14.下列说法正确的是( )
| A. | 吸入雾霾、PM2.5等对人体健康没有危害 | |
| B. | 电解水实验中正极和负极产生的两种气体质量比为1:2 | |
| C. | 呼出的气体中含量最多的气体是二氧化碳 | |
| D. | 在用红磷测定空气中氧气的体积分数时,充分反应后,需将装置冷却至室温再打开弹簧夹读数,否则测量结果偏低 |
4.实验室常用加热氯酸钾和二氧化锰混合物的方法制取氧气,写出反应的文字或符号表达式:氯酸钾$\stackrel{二氧化锰}{→}$氯化钾+氧气(或2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑).
小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
【提出猜想】除二氧化锰、氧化铜外,氧化铁也可以作氯酸钾分解的催化剂.
【完成实验】按下表进行分析:测定分解温度(分解温度越低,催化效果越好).
【分析数据、得出结论】
(1)由实验①与实验④对比,证明猜想合理.
(2)已知实验所用的三种物质中,催化效果最好的是二氧化锰,则实验②的分解温度<370(填“>”、“=”或“<”).
【反思】
(1)若要证明氧化铁是该反应的催化剂,还要验证它在化学反应前后质量和化学性质不变;
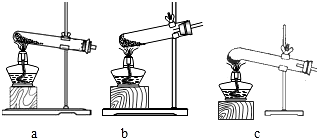
(2)已知氯酸钾的熔点为356℃,结合上表数据,你认为加热氯酸钾和氧化铁的混合物制氧气最适宜的装置是c(填字母)
(3)同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证将氯酸钾与不同颗粒大小的同种催化剂按质量比1:1混合,加热,分别测定分解温度将氯酸钾与不同颗粒大小的同种催化剂按质量比1:1混合,加热,分别测定分解温度.
小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
【提出猜想】除二氧化锰、氧化铜外,氧化铁也可以作氯酸钾分解的催化剂.
【完成实验】按下表进行分析:测定分解温度(分解温度越低,催化效果越好).
| 实验编号 | 实验药品 | 分解温度(℃) |
| ① | 氯酸钾 | 580 |
| ② | 氯酸钾、二氧化锰(质量比1:1) | 未测 |
| ③ | 氯酸钾、氧化铜(质量比l:1) | 370 |
| ④ | 氯酸钾、氧化铁(质量比1:1) | 390 |
(1)由实验①与实验④对比,证明猜想合理.
(2)已知实验所用的三种物质中,催化效果最好的是二氧化锰,则实验②的分解温度<370(填“>”、“=”或“<”).
【反思】
(1)若要证明氧化铁是该反应的催化剂,还要验证它在化学反应前后质量和化学性质不变;
(2)已知氯酸钾的熔点为356℃,结合上表数据,你认为加热氯酸钾和氧化铁的混合物制氧气最适宜的装置是c(填字母)

(3)同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证将氯酸钾与不同颗粒大小的同种催化剂按质量比1:1混合,加热,分别测定分解温度将氯酸钾与不同颗粒大小的同种催化剂按质量比1:1混合,加热,分别测定分解温度.
11. 核电荷数为3~18的元素的原子结构示意图等信息如下,请回答下列问题:
核电荷数为3~18的元素的原子结构示意图等信息如下,请回答下列问题:
(1)氯元素在元素周期表中的位置是第3周期、VIIA,该元素的原子在化学反应中容易得电子.(填“得”或“失”)
(2)不同种元素最本质的区别是A.
A.质子数不同 B.最外层电子数不同
C.中子数不同 D.相对原子质量不同
(3)如图,为某粒子结构示意图,当x-y=8时,该粒子符号为S2-.
 核电荷数为3~18的元素的原子结构示意图等信息如下,请回答下列问题:
核电荷数为3~18的元素的原子结构示意图等信息如下,请回答下列问题:| 族 周期 | I A | II A | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | 3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
| 3 | 11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(2)不同种元素最本质的区别是A.
A.质子数不同 B.最外层电子数不同
C.中子数不同 D.相对原子质量不同
(3)如图,为某粒子结构示意图,当x-y=8时,该粒子符号为S2-.
9.下列图示实验操作中,正确的是( )
| A. |  滴加液体 | B. |  检验氧气是否收集满 | ||
| C. |  测空气中氧气含量 | D. |  读取液体的体积 |


