题目内容
【题目】金属和金属材料在生产、生活中有广泛的用途,请用金属的有关知识填空。
(1)锂电池可作为无人机的动力,其工作原理是:FePO4+Li![]() LiFePO4.在LiFePO4中锂元素显+1价,磷元素显+5价,则铁元素的化合价是_____。
LiFePO4.在LiFePO4中锂元素显+1价,磷元素显+5价,则铁元素的化合价是_____。
(2)钛(Ti)具有硬度大,密度小,熔点高,抗腐蚀性能好等优良性能,被誉为“未来金属”。已知Ti2(SO4)3溶于水溶液呈紫色。Ti2O3(紫黑色固体)在加热条件下可溶于硫酸,生成Ti2(SO4)3.可观察的现象是_____,反应的化学方程式为_____。
(3)工业上,用一氧化碳和赤铁矿炼铁的化学方程式为_____,计算用1000t含氧化铁80%的赤铁矿石,理论上能冶炼出铁的质量为_____t。
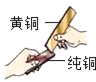
(4)黄铜片(铜锌合金)与铜片互相刻划时,(如图所示),纯铜片上留下明显的划痕,说明_____;
将它们分别放入稀硫酸中能产生气泡的是_____;涉及的化学反应可用化学方程式表示为_____。
【答案】+2 紫黑色的固体溶解/消失溶液由无色变成紫色 Ti2O3 + 3H2SO4![]() Ti2(SO4)3 + 3H2O 3CO + Fe2O3
Ti2(SO4)3 + 3H2O 3CO + Fe2O3 ![]() 2Fe + 3CO2 560 合金的硬度比组成它们的纯金属要大 黄铜片 Zn + H2SO4 ===ZnSO4 +H2↑
2Fe + 3CO2 560 合金的硬度比组成它们的纯金属要大 黄铜片 Zn + H2SO4 ===ZnSO4 +H2↑
【解析】
(1)在LiFePO4中锂元素显+1价,磷元素显+5价,氧元素显-2价,设铁元素的化合价为x,则(+1)+x+(+5)+(-2)×4=0,则x=+2;
(2)Ti2O3(紫黑色固体)在加热条件下与硫酸反应生成Ti2(SO4)3和水,观察到紫黑色固体溶解,溶液由无色变成紫色,反应的化学方程式为:Ti2O3+3H2SO4 ![]() Ti2(SO4)3+3H2O;
Ti2(SO4)3+3H2O;
(3)赤铁矿的主要成分是氧化铁,一氧化碳还原氧化铁的化学方程式是:3CO+Fe2O3![]() 2Fe+3CO2由质量守恒定律,反应前后铁元素的质量不变,1000t×80%氧化铁中铁元素的质量即为炼出铁的质量,160t氧化铁中铁元素的质量为1000t×80%×
2Fe+3CO2由质量守恒定律,反应前后铁元素的质量不变,1000t×80%氧化铁中铁元素的质量即为炼出铁的质量,160t氧化铁中铁元素的质量为1000t×80%×![]() =560t;
=560t;
(4)将纯铜片和黄铜片互相刻画,纯铜片上留下明显的划痕,说明黄铜的硬度比纯铜的硬度大;
(5)黄铜中的锌会与硫酸反应生成氢气和硫酸锌,将它们分别放入稀硫酸中能产生气泡的是:黄铜片,化学方程式为:Zn + H2SO4 =ZnSO4+H2↑。

【题目】工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4,为了测定铁红中铁的质量分数,兴趣小组的同学进行了如下实验,请你参与过程分析。
(资料1)草酸晶体(H2C2O43H2O)在浓H2SO4作用下受热分解,化学方程式为:
H2C2O43H2O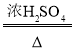 CO2↑+CO↑+4H2O
CO2↑+CO↑+4H2O
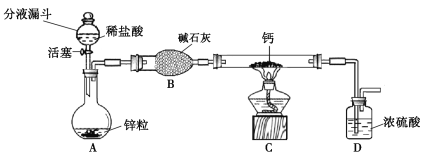
(问题讨论)用如图所示装置进行实验:
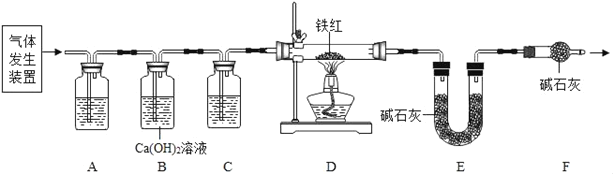
(1)实验前应先检查装置的气密性。
(2)进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是_____(填字母编号)
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(3)B装置的作用是_____。
(4)对D装置加热前和停止加热后,都要通入过量的CO,其作用分别是:
①加热前将装置中的空气排出,防止发生爆炸
②停止加热后_____。
(数据分析与计算)
(资料2)铁的常见氧化物中铁的质量分数
铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
铁的质量分数 | 77.8% | 70.0% | 72.4% |
(5)称取铁红样品10.0g用上述装置进行实验,测定铁红中铁的质量分数。
①D中充分反应后得到Fe粉的质量为mg,则m的取值范围是_____。
②实验前后称得E装置增重6.6g,则此铁红中铁的质量分数是_____。(计算结果精确到0.1%)
(实验评价)
(6)本实验中如果缺少C装置(不考虑其它因素),则测得样品中铁的质量分数会_____(填“偏小”、“不变”或“偏大”)。
【题目】除去下列各物质中含有的少量杂质,所选用的试剂、操作方法都正确的是( )
选项 | 物质 | 杂质 | 操作方法 |
A | CaO固体 | CaCO3固体 | 加入足量水,过滤 |
B | CuSO4溶液 | H2SO4 | 加入过量CuO粉末,过滤 |
C | NaOH溶液 | Ca(OH)2 | 加入过量Na2CO3溶液,过滤 |
D | KNO3溶液 | K2CO3 | 加入适量CaCl2溶液,过滤 |
A. AB. BC. CD. D