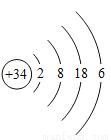
题目内容
请判断下列说法的正误:(在括号内打“√”或“×”)
(1)原子是由原子核和核外电子构成的(____)
(2)任何原子都是由质子、中子和核外电子构成的(____)
(3)决定原子种类的是中子数(____)
(4)原子不显电性是因为原子中没有带电的微粒(____)
(5)在原子中,质子数一定等于中子数(____)
(6)在原子中,质子数一定等于核外电子数(____)
(7)核外电子数决定原子的种类(____)
(8)金属原子的最外层电子数一般少于4个(____)
√××××√×√ 【解析】 (1)原子是由原子核和核外电子构成的,故正确; (2)氢原子中没有中子,故错误; (3)质子数决定原子的种类,故错误; (4)一个质子带一个单位正电荷,中子不带电,在原子内核内质子数等于核外电子数,一个电子带一个单位负电荷,所以原子核所带电量和核外电子所带的电量相等,电性相反,所以整个原子不显电性,故错误; (5)在原子中,质子数一定...
练习册系列答案
相关题目
某同学向一定质量的石灰石中加入7.3%的稀盐酸来制取二氧化碳,测得反应过程中溶液的pH与加入的稀盐酸的关系如下图所示。

(1)该同学能收集到的二氧化碳的质量________?(写出计算过程)
(2)该同学把制取气体后的废液过滤,向滤液中加入10.6%的Na2CO3溶液,测得加入的Na2CO3溶液与产生的沉淀数据如下:
Na2CO3溶液质量/g | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
沉淀质量/g | 0 | 1 | n | 3 | 4 | 5 | m |
则m=________。加入10gNa2CO3溶液时发生反应的化学方程式是________。
2.2g5Na2CO3+CaCl2=CaCO3↓+2NaCl 【解析】 (1)根据图示可知与碳酸钙反应的HCl的质量=50g×7.3%=3.65g,结合方程式可以计算二氧化碳的质量;(2)根据图表可知前10gNa2CO3溶液加入后没有生成沉淀,是Na2CO3与过量的盐酸反应,之后每消耗10gNa2CO3溶液产生1g沉淀,所以n=2,再根据氯化钙的质量分析生成沉淀的最大量,分析m的数值。...

 ,在反应中若得到一个电子即变成氯离子C1—
,在反应中若得到一个电子即变成氯离子C1—