题目内容
15.有三种失去标签的无色透明的溶液分别是无色酚酞、稀HCl、CaCl2溶液请你用一种试剂将其鉴别开来,这种试剂是( )| A. | 氢氧化钠溶液 | B. | 碳酸钠溶液 | C. | 硝酸银溶液 | D. | 硫酸 |
分析 根据三种物质与同种试剂反应产生的不同现象来鉴别它们,若两种物质与同种物质反应的现象相同,则无法鉴别它们.
解答 A、氢氧化钠能使酚酞试液变成红色,而和稀盐酸、氯化钙混合都没有明显的现象,不能鉴别,故选项错误;
B、碳酸钠能使酚酞试液变成红色,和稀盐酸混合产生气泡,和氯化钙混合产生沉淀,现象不同,可以鉴别,故选项正确;
C、硝酸银和稀盐酸、氯化钙混合都产生白色沉淀,现象相同,不能鉴别,故选项错误;
D、稀硫酸和三种物质混合都没有明显的现象,不能鉴别,故选项错误;
故选项为:B.
点评 本题考查了常见物质的鉴别,在解决鉴别物质题时,判断的依据是:所选试剂需要与待鉴别的物质反应并出现明显不同的现象.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
5.关于生活中常见的盐,下列说法中错误的是( )
| A. | 碳酸钙可用作补钙剂 | |
| B. | 食盐可用于调味和腌渍蔬菜、鱼、肉、蛋等 | |
| C. | 纯碱在农业上常用于改良酸性土壤 | |
| D. | 小苏打是焙制糕点所用的发酵粉的主要成分之一 |
6.以下做法错误的是( )
| A. | 使用乙醇汽油,可适当节省石油资源,并能避免汽车尾气的污染 | |
| B. | 塑料长期堆积既破坏土壤又污染地下水,应将塑料制品分类回收,可有效缓解“白色污染” | |
| C. | 进入久未开启的菜窖之前,应先进行灯火实验 | |
| D. | 一方面植树、造林、种草,另一方面利用和开发太阳能、核能等新能源,能有效抑制温室效应 |
3.下列叙述中属于食盐用途的是( )
①日常烹饪中作调味品
②重要的化工原料如制造氢氧化钠
③制盐酸
④腌制食品.
①日常烹饪中作调味品
②重要的化工原料如制造氢氧化钠
③制盐酸
④腌制食品.
| A. | ①② | B. | ①④ | C. | ①②④ | D. | 全部 |
10.下列说法中正确的是( )
| A. | 具有相同质子数的微粒一定属于同一种元素 | |
| B. | 由不同种元素组成的物质一定是化合物 | |
| C. | 盐的组成元素中一定不含氢元素 | |
| D. | 不饱和溶液变成饱和溶液后溶质的质量分数可能不变 |
4.某化学实验活动小组的同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验,请你参与他们进行的探究活动.
【提出问题】久置氢氧化钠固体的成分是什么?
【猜想与假设】
猜想Ⅰ:全部是NaOH;
猜想Ⅱ:全部是Na2CO3;
猜想Ⅲ:NaOH和Na2CO3.
【实验与探究】
实验如下:
(2)为了进一步的验证猜想结果,小明同学提出如下实验方案:继续步骤二的实验,过滤,然后向滤液中滴加无色酚酞试液,若酚酞变红,则猜想Ⅲ成立;若酚酞不变红,则猜想Ⅱ成立.
小华同学立即对小明同学的方案提出了质疑,通过查阅资料知道,氯化钡溶液呈中性,不能使无色酚酞试液变红,但碳酸钠溶液呈碱(填“酸”或“碱”)性,能使酚酞变红,因此他认为该方案的操作步骤中应该改进的是将步骤二中的氯化钡溶液改为加入过量的氯化钡溶液.
(3)实验小组的同学展开讨论,又提出了一个定量实验方案,通过测定产生沉淀的质量来证明猜想Ⅱ或Ⅲ成立.实验如下:准确称取m克固体样品于试管中,加蒸馏水完全溶解,然后滴加足量氯化钡溶液,充分反应后过滤、洗涤、干燥称得沉淀的质量为n克,若猜想Ⅱ成立,则m与n的关系式为(用含m和n的等式或不等式表示,下同)n=$\frac{197m}{106}$;若猜想Ⅲ成立,则m与n的关系式为0<n<$\frac{197m}{106}$.
【反思与交流】久置的固体氢氧化钠变质的原因是(用化学方程式表示)2NaOH+CO2═Na2CO3+H2O.
【提出问题二】
某兴趣小组对部分变质的氢氧化钠固体进行提纯,设计了如下操作流程,请回答:
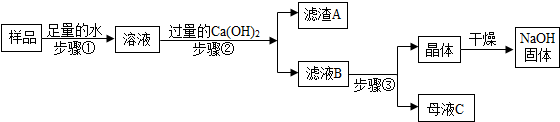
(1)步骤①中玻璃棒的作用是:搅拌,加速溶解.
(2)滤渣A的成分是CaCO3(填化学式);步骤③所包含的具体操作是加热浓缩、降温结晶、过滤,母液C中一定含有的溶质是氢氧化钠、氢氧化钙.
(3)步骤②反应的化学方程式为Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;加入过量Ca(OH)2的目的是将溶液中的碳酸钠全部转化成氢氧化钠.
【提出问题】久置氢氧化钠固体的成分是什么?
【猜想与假设】
猜想Ⅰ:全部是NaOH;
猜想Ⅱ:全部是Na2CO3;
猜想Ⅲ:NaOH和Na2CO3.
【实验与探究】
实验如下:
| 实验操作步骤 | 实验现象 | 结论及解释 |
| 步骤一:取少量固体样品于试管中,加蒸馏水完全溶解,然后加入足量的稀盐酸. | 实验过程中有气泡产生. | 则证明猜想Ⅰ成立 |
| 步骤二:另取少量固体样品于试管中,加蒸馏水完全溶解,然后滴加氯化钡溶液. | 实验过程中产生 白色沉淀. | 则证明猜想Ⅱ或Ⅲ成立.此过程中发生反应的化学方程式为BaCl2+Na2CO3═BaCO3↓+2NaCl. |
小华同学立即对小明同学的方案提出了质疑,通过查阅资料知道,氯化钡溶液呈中性,不能使无色酚酞试液变红,但碳酸钠溶液呈碱(填“酸”或“碱”)性,能使酚酞变红,因此他认为该方案的操作步骤中应该改进的是将步骤二中的氯化钡溶液改为加入过量的氯化钡溶液.
(3)实验小组的同学展开讨论,又提出了一个定量实验方案,通过测定产生沉淀的质量来证明猜想Ⅱ或Ⅲ成立.实验如下:准确称取m克固体样品于试管中,加蒸馏水完全溶解,然后滴加足量氯化钡溶液,充分反应后过滤、洗涤、干燥称得沉淀的质量为n克,若猜想Ⅱ成立,则m与n的关系式为(用含m和n的等式或不等式表示,下同)n=$\frac{197m}{106}$;若猜想Ⅲ成立,则m与n的关系式为0<n<$\frac{197m}{106}$.
【反思与交流】久置的固体氢氧化钠变质的原因是(用化学方程式表示)2NaOH+CO2═Na2CO3+H2O.
【提出问题二】
某兴趣小组对部分变质的氢氧化钠固体进行提纯,设计了如下操作流程,请回答:

(1)步骤①中玻璃棒的作用是:搅拌,加速溶解.
(2)滤渣A的成分是CaCO3(填化学式);步骤③所包含的具体操作是加热浓缩、降温结晶、过滤,母液C中一定含有的溶质是氢氧化钠、氢氧化钙.
(3)步骤②反应的化学方程式为Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;加入过量Ca(OH)2的目的是将溶液中的碳酸钠全部转化成氢氧化钠.
5.化学兴趣小组同学发现实验台上按如图所示顺序摆放着6瓶不同的无色溶液(如图所示:A、B、C、D、E、F代表对应的溶液).其中E溶液的试剂瓶标签破损.为此,他们做了如下探究:

【提出问题】E溶液的成分是什么?
【初步判断】根据受损标签及实验室药品分类摆放原则,E溶液可能是碱或盐的溶液.
【提出猜想】
猜想Ⅰ:NaOH溶液;
猜想Ⅱ:Na2CO3溶液;
猜想Ⅲ:Na2SO4溶液;猜想Ⅳ:NaCl溶液(任写一种).
设计并实验兴趣小组的同学为验证“猜想Ⅱ”是否正确,设计并完成如下表所示实验.
【分析与推理】
①完成“实验一”后,李成同学即认为“猜想Ⅰ”正确,张平同学认为“猜想Ⅰ”不一定正确,他的理由是碳酸钠和氢氧化钠溶液均显碱性.
②何刚同学认为只需要完成“实验二”即可得出“猜想Ⅱ”正确的结论,王强认为他的说法不合理,他的理由是因NaOH溶液变质也会产生Na2CO3.
③请写出“实验三”中发生反应的化学方程式Na2CO3+BaCl2=2NaCl+BaCO3↓.
【反思与评价】
①经过讨论,同学们认为“实验一”存在明显操作错误,该错误是把pH试纸浸入待测液;②观察发现D、E试剂瓶的瓶塞是橡胶塞,使用橡胶塞的原因是碱性物质易与玻璃中的SiO2发生反应的产物使瓶口与塞子粘合在一起.

【提出问题】E溶液的成分是什么?
【初步判断】根据受损标签及实验室药品分类摆放原则,E溶液可能是碱或盐的溶液.
【提出猜想】
猜想Ⅰ:NaOH溶液;
猜想Ⅱ:Na2CO3溶液;
猜想Ⅲ:Na2SO4溶液;猜想Ⅳ:NaCl溶液(任写一种).
设计并实验兴趣小组的同学为验证“猜想Ⅱ”是否正确,设计并完成如下表所示实验.
| 实验方案 | 实验一 | 实验二 | 实验三 |
| 实验操作 |  |  |  |
| 实验现象 | 试纸变色,对照比色卡,pH>7 | 有无色无味气体产生 | 有白色沉淀产生 |
| 实验结论 | 猜想Ⅱ正确 | ||
①完成“实验一”后,李成同学即认为“猜想Ⅰ”正确,张平同学认为“猜想Ⅰ”不一定正确,他的理由是碳酸钠和氢氧化钠溶液均显碱性.
②何刚同学认为只需要完成“实验二”即可得出“猜想Ⅱ”正确的结论,王强认为他的说法不合理,他的理由是因NaOH溶液变质也会产生Na2CO3.
③请写出“实验三”中发生反应的化学方程式Na2CO3+BaCl2=2NaCl+BaCO3↓.
【反思与评价】
①经过讨论,同学们认为“实验一”存在明显操作错误,该错误是把pH试纸浸入待测液;②观察发现D、E试剂瓶的瓶塞是橡胶塞,使用橡胶塞的原因是碱性物质易与玻璃中的SiO2发生反应的产物使瓶口与塞子粘合在一起.
