题目内容
15.100克某浓度的硫酸恰好与13克的锌完全起反应.请计算:(1)完全反应后生成氢气的质量为0.4克(结果精确到0.1克)
(2)反应后所得溶液中溶质的质量分数(写出计算过程,结果精确到0.1%)
分析 锌的质量为纯净物的质量,而硫酸的质量是混合物的质量,所以可以根据锌的质量结合对应的化学方程式求算生成的氢气的质量和硫酸锌的质量,进而求算对应溶液中硫酸锌的质量分数.
解答 解:设13g锌完全反应生成的氢气的质量为x,生成的硫酸锌的质量为y.
Zn+H2SO4=ZnSO4+H2↑
65 161 2
13g y x
$\frac{65}{13g}$=$\frac{161}{y}$=$\frac{2}{x}$
x=0.4g
y=32.2g
则所得溶液中硫酸锌的质量分数为$\frac{32.2g}{13g+100g-0.4g}$×100%≈28.6%
答:(1)完全反应后生成氢气的质量为 0.4克;(2)反应后所得溶液中溶质的质量分数为28.6%.
点评 在化学方程式计算中,纯净物的质量可以用于化学方程式的计算,而混合物的质量不可以用于化学方程式的直接计算,另外需要首先确定多少数据需要计算.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.在“氧气的制取和性质”的实验中,某同学在纱窗网上取一段细铁丝,在自己收集到的氧气中做“铁丝在氧气中燃烧”的实验,结果没有观察到“火星四射”的现象.造成此实验失败的原因不可能是( )
| A. | 收集到的氧气量太少或纯度太低 | B. | 铁丝表面生锈 | ||
| C. | 集气瓶底部没有铺一薄层细沙 | D. | 铁丝的温度较低 |
6.对下图所示实验现象进行分析得出的结论中,错误的是( )
| A. |  甲烷燃烧生成二氧化碳和水 | |
| B. |  铁能在氧气中燃烧 | |
| C. |  白磷的着火点比红磷的低 | |
| D. |  二氧化碳的密度比空气大,不燃烧也不支持燃烧 |
3.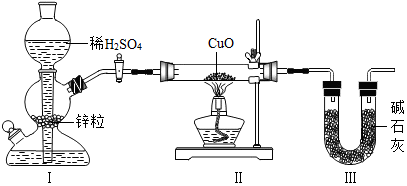 用如图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管(包 括氧化铜)的质量差和 U 型管(包括碱石灰)的质量差,计算得氢元素和氧元素的质量比 大于 1﹕8.下列对导致这一结果的原因的分析中合理的是( )
用如图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管(包 括氧化铜)的质量差和 U 型管(包括碱石灰)的质量差,计算得氢元素和氧元素的质量比 大于 1﹕8.下列对导致这一结果的原因的分析中合理的是( )
 用如图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管(包 括氧化铜)的质量差和 U 型管(包括碱石灰)的质量差,计算得氢元素和氧元素的质量比 大于 1﹕8.下列对导致这一结果的原因的分析中合理的是( )
用如图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管(包 括氧化铜)的质量差和 U 型管(包括碱石灰)的质量差,计算得氢元素和氧元素的质量比 大于 1﹕8.下列对导致这一结果的原因的分析中合理的是( )| A. | I、Ⅱ装置之间缺少干燥装置 | |
| B. | III 装置干燥剂量不足,水没有被完全吸收 | |
| C. | CuO 没有全部被还原 | |
| D. | Ⅱ装置中玻璃管内有水冷凝 |
4.下列实验对应的图象正确的是( )
 |  |  |  |
| A、分别向等质量的镁和锌中滴加足量的盐酸 | B、向pH=2的盐酸中滴加过量的氢氧化钠溶液 | C、向BaCl2和NaOH混合溶液中逐滴加入稀硫酸至过量 | D、向盐酸和氯化铜的混合溶液中加氢氧化钾溶液 |
| A. | A | B. | B | C. | C | D. | D |


 B.
B. 
 D.
D. 