题目内容
已知A是地壳中含量居第二位的金属元素,B和C是A的二种氧化物,其中B是红色粉末,C是黑色粉末,在一定条件下,无色气体D能与B和C发生反应,生成A和另一种无色气体E,E能使澄清石灰水变浑浊,根据以上事实推断:
(1)A、B、C、D、E的化学式:
A
(2)写出下列化学方程式
A→C
D+B→A+E
E使澄清石灰水变浑浊
(1)A、B、C、D、E的化学式:
A
Fe
Fe
BFe2O3
Fe2O3
CFe3O4
Fe3O4
DCO
CO
ECO2
CO2
(2)写出下列化学方程式
A→C
3Fe+2O2
Fe3O4
| ||
3Fe+2O2
Fe3O4
| ||
D+B→A+E
Fe3O4+4CO
3Fe+4CO2
| ||
Fe3O4+4CO
3Fe+4CO2
| ||
E使澄清石灰水变浑浊
Ca(OH)2+CO2=CaCO3↓+H2O
Ca(OH)2+CO2=CaCO3↓+H2O
.分析:依据A是地壳中含量居第二位的金属元素可知A是铁,B和C是A的二种氧化物,其中B是红色粉末C是黑色粉末可确定B是氧化铁;C是四氧化三铁;E能使澄清石灰水变浑浊可知E是二氧化碳,以此分析解答即可;
解答:解:由于A是地壳中含量居第二位的金属元素可知A是铁,B和C是A的二种氧化物,其中B是红色粉末C是黑色粉末可确定B是氧化铁;C是四氧化三铁;E能使澄清石灰水变浑浊可知E是二氧化碳,由于D能够还原铁的两种氧化物,且生成二氧化碳,所以D是一氧化碳;
(1)由以上分析可知A、B、C、D、E的化学式分别为Fe、Fe2O3、Fe3O4、CO、CO2;
(2)A→C的过程是铁丝的燃烧生成四氧化三铁的过程,其反应的方程式为:3Fe+2O2
Fe3O4;
D+B→A+E是炼铁原理的反应,其产物是铁和二氧化碳,方程式为:Fe3O4+4CO
3Fe+4CO2 .
E使澄清石灰水变浑浊的方程式为:Ca(OH)2+CO2=CaCO3↓+H2O;
故答案为:(1)Fe;Fe2O3;Fe3O4;CO;CO2;
(2)3Fe+2O2
Fe3O4;Fe3O4+4CO
3Fe+4CO2 ;Ca(OH)2+CO2=CaCO3↓+H2O;
(1)由以上分析可知A、B、C、D、E的化学式分别为Fe、Fe2O3、Fe3O4、CO、CO2;
(2)A→C的过程是铁丝的燃烧生成四氧化三铁的过程,其反应的方程式为:3Fe+2O2
| ||
D+B→A+E是炼铁原理的反应,其产物是铁和二氧化碳,方程式为:Fe3O4+4CO
| ||
E使澄清石灰水变浑浊的方程式为:Ca(OH)2+CO2=CaCO3↓+H2O;
故答案为:(1)Fe;Fe2O3;Fe3O4;CO;CO2;
(2)3Fe+2O2
| ||
| ||
点评:此题属于推断题,对常见物质的物理及化学性质要熟练掌握,对常见化学反应方程式要准确掌握,只有这样才能顺利解题;

练习册系列答案
相关题目
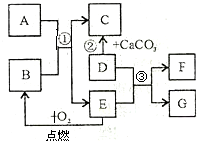 初中化学常见物质A-G有如右图所示的转化关系(部分反应条件及物质已略去),已知A、C所含元素相同且均为气体,反应②为实验室制取气体C的方法;E元素在地壳中含量居金属元素的第二位;F是最轻的气体.请回答下列问题:
初中化学常见物质A-G有如右图所示的转化关系(部分反应条件及物质已略去),已知A、C所含元素相同且均为气体,反应②为实验室制取气体C的方法;E元素在地壳中含量居金属元素的第二位;F是最轻的气体.请回答下列问题: A 是人体胃酸的主要成分;B是一种常用的食品干燥剂,与水反应放出大量的热;C微溶于水;E 是地壳中含量居第二位的金属元素。
A 是人体胃酸的主要成分;B是一种常用的食品干燥剂,与水反应放出大量的热;C微溶于水;E 是地壳中含量居第二位的金属元素。