题目内容
【题目】20℃时,将等质量的甲、乙两种固体物质,分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,甲、乙两种物质的溶解度曲线如图3.请结合图示回答下列问题: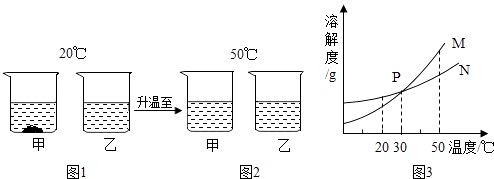
(1)图1中一定为饱和溶液的是 .
(2)图2中甲、乙两溶液中溶质质量分数的大小关系为 .
(3)图3中表示乙的溶解度曲线是;
(4)P点表示的含义是 .
【答案】
(1)甲
(2)相等或甲=乙
(3)N
(4)30℃时,甲、乙两种固体物质的溶解度相等
【解析】解:(1)从图1中可以知道甲没有完全溶解,则说明甲中形成的溶液为饱和溶液;(2)图2中相同质量的溶剂溶解了相同质量的溶质,所以它们形成溶液的质量也相等,结合溶质的质量分数的计算公式可以知道,它们形成的溶液中溶质的质量分数也相等;(3)根据图1中信息可以知道20℃时甲的溶解度小于乙的溶解度,而图3中在20℃时,N曲线的溶解度大于M曲线的溶解度,故N表示的是乙物质的溶解度曲线;(4)根据溶解度曲线的意义可以知道P点表示30℃时,甲、乙两种固体物质的溶解度相等.
故答案为:(1)甲;(2)相等或甲=乙;(3)N;30℃时;(4)30℃时,甲、乙两种固体物质的溶解度相等.
1)根据饱和溶液的定义进行解答;(2)根据题意可以知道图2中相同质量的溶剂溶解了相同质量的溶质,结合溶质的质量分数的计算公式可以完成解答;(3)根据图中信息可以知道20℃时甲的溶解度小于乙的溶解度,结合图3可以完成解答;(4)两条溶解度曲线的交点表示该点所示的温度下,两物质的溶解度是相同的,可以据此判断P点的意义.

 小题狂做系列答案
小题狂做系列答案【题目】实验与探究是化学学习的重要方法和内容,李明看到家里多年未用的铜制火锅上有绿色的锈迹,他对绿色锈迹的成分和性质产生了浓厚兴趣. 【查阅资料】
①绿色锈迹是碱式碳酸铜[Cu2(OH)2CO3],受热易分解;
②无水硫酸铜为白色粉末,遇水变蓝;
③碱石灰是CaO和NaOH的固体混合物,NaOH与CO2反应生成碳酸钠固体和水
④氧化铜与稀硫酸反应生成蓝色溶液,碳粉不与稀硫酸反应也不溶解在稀硫酸中.
【发现问题】
查阅资料后,该同学将少量碱式碳酸铜放入试管中加热,发现试管中的固体由绿色变成黑色,同时试管壁上有无色液滴生成.
为了进一步确定碱式碳酸铜受热分解的产物,进行了如下探究:
探究一:碱式碳酸铜受热分解生成的黑色固体成分.
(1)【猜想与假设】该黑色固体可能是①碳粉;②;③碳和氧化铜的混合物.
(2)【设计方案】请帮助该同学完成下述实验报告:
实验操作与现象 | 实验结论 |
猜想②正确 |
探究二:碱式碳酸铜受热分解还会生成CO2和H2O.
【进行实验】选择如下图所示装置进行验证
步骤一:连接A和B,打开活塞,通入一段时间的空气;
步骤二:点燃酒精灯,依次连接装置A→B→→(填“C”,“D”);
步骤三:点燃酒精灯,观察到明显现象后,停止加热
(3)【解释与结论】 ①当观察到 , 说明碱式碳酸铜受热分解生成了CO2和H2O,写出装置C中反应的化学方程式;
②写出Cu2(OH)2CO3受热分解的化学方程式 .
(4)【反思与评价】 上述装置中A的作用是 .







