题目内容
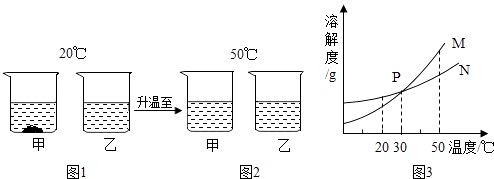
【题目】如图是A,B,C三种固体物质的溶解度曲线. 
(1)在t1℃时,A,B,C三种固体物质的溶解度最大的是;
(2)P点的含义是:;
(3)在t2℃时,将20gC物质放入100g水中,充分溶解后所得溶液为(填“饱和”或“不饱和”)溶液;
(4)将t1℃的A,B两种物质的饱和溶液升温到t2℃时,所得溶液中溶质质量分数的关系为AB(填“>”、“=”或“<”).
【答案】
(1)B
(2)t2℃时,A,B两种物质的溶解度相同
(3)饱和
(4)<
【解析】解:(1)t1℃时,A,B,C三种物质的溶解度最大的是B;(2)点P是t1℃时A,B的溶解度的曲线的交点,含义是该温度下二者的溶解度相等;(3)在t2℃时C的溶解度是15g,所以将20gC物质放入100g水中,充分溶解后最多溶解15g,所得溶液为饱和溶液;(4)AB的溶解度随温度的升高而增大,据饱和时质量分数的计算式 ![]() ×100%可知:溶解度大则溶质的质量分数大,t1℃时B的溶解度大,所以A,B两种物质的饱和溶液溶质的质量分数A<B;将t1℃的A,B两种物质的饱和溶液升温到t2℃时,其溶液中溶质、溶剂的质量不变,故所得溶液中溶质质量分数的关系为A小于B; 所以答案是:(1)B; (2)t2℃时,A、B两种物质的溶解度相同;(3)饱和; (4)<.
×100%可知:溶解度大则溶质的质量分数大,t1℃时B的溶解度大,所以A,B两种物质的饱和溶液溶质的质量分数A<B;将t1℃的A,B两种物质的饱和溶液升温到t2℃时,其溶液中溶质、溶剂的质量不变,故所得溶液中溶质质量分数的关系为A小于B; 所以答案是:(1)B; (2)t2℃时,A、B两种物质的溶解度相同;(3)饱和; (4)<.
【考点精析】解答此题的关键在于理解固体溶解度曲线及其作用的相关知识,掌握1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和),以及对溶质的质量分数、溶解性和溶解度的关系的理解,了解溶质质量分数 =溶质质量/溶液质量*100% ;溶解度=溶质质量/溶剂质量*100g (必须选取饱和溶液);溶液质量=溶质质量(克)+溶剂质量(克) ;对于饱和溶液,溶液质量分数w = S/(S+100);所以溶解度S = 100/(1/w-1).

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案