题目内容
2.主要成分是(其杂质不参加任何反应),厂家当地山以确定价格,他们取样20克,并把200克稀盐酸分四次加入,充分反应后,每次剩余固体质量如表.| 稀盐酸的用量 | 剩余固体的质量/g |
| 第一次加入50g | 15g |
| 第二次再加入50g | 10g |
| 第三次再加入50g | 5g |
| 第四次再加入50g | 3g |
(2)20克样品含有杂质质量是3克.
(3)样品中碳酸钙的质量分数是多少?
(4)所用盐酸的质量分数是多少?
(5)求第一次加入盐酸后所得溶液中溶质的质量分数是多少?
分析 (1)从表中数据可知第1、2、3次试验中盐酸是完全反应完的;
(2)从表中数据可知加入200g盐酸,20g样品中的碳酸钙全参加反应,样品中的杂质为3g;
(3)碳酸钙的质量=样品的质量-杂质的质量,进而求出碳酸钙的质量分数;
(4)根据二氧化碳的质量,然后根据碳酸钙与稀盐酸反应的方程式,求解即可;
(5)根据50g这样的盐酸能和5g碳酸钙反应,结合碳酸钙和盐酸反应的化学方程式求出氯化钙的质量,然后除以溶液的质量即可得溶质的质量分数.
解答 解:(1)从表中数据可知第 1、2、3次试验中盐酸是完全反应完的;
(2)从表中数据可知加入200g盐酸,20g样品中的碳酸钙全参加反应,样品中的杂质为3g;
(3)碳酸钙的质量=样品的质量-杂质的质量,进而求出碳酸钙的质量分数是$\frac{20g-3g}{20g}×100%$=85%;
(4)50g这样的盐酸能和5g碳酸钙反应,设50g这样的盐酸中溶质的质量为x.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73
5g x
则$\frac{100}{73}=\frac{5g}{x}$,解得x=3.65g
盐酸中溶质的质量分数为$\frac{3.65g}{50g}$×100%=7.3%;
(5)50g这样的盐酸能和5g碳酸钙反应,设反应生成的氯化钙的质量为y,生成的二氧化碳的质量为z.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111 44
5g y z
则$\frac{100}{111}=\frac{5g}{y}$,$\frac{100}{44}=\frac{5g}{z}$,解得y=5.55g,z=2.2g.
第一次加入盐酸后所得溶液中溶质的质量分数是$\frac{5.55g}{50g+5g-2.2g}$×100%≈10.5%;
故答案为:
(1)1、2、3;(2)3g;(3)85%;(4)7.3%;(5)10.5%;
点评 解答该题要从表中数据分析入手,抓住什么时候碳酸钙和稀盐酸完全反应是关键,并且计算要细心.

 硒对人体有防癌、抗癌作用.如图是硒元素在元素周期表中的部分信息,下列有关说法正确的是( )
硒对人体有防癌、抗癌作用.如图是硒元素在元素周期表中的部分信息,下列有关说法正确的是( )| A. | 硒属于金属元素 | B. | 硒的原子序数是34 | ||
| C. | 硒原子核内中子数是34 | D. | 硒的相对原子质量是78.96g |
| A. | 镁+氧气$\stackrel{点燃}{→}$氧化镁 | B. | 高锰酸钾$\stackrel{△}{→}$锰酸钾+二氧化锰+氧气 | ||
| C. | 石蜡+氧气$\stackrel{点燃}{→}$二氧化碳+水 | D. | 氢气+四氧化三铁$\stackrel{△}{→}$铁+水 |
| A. | 随意弃置废旧电池 | B. | 含二氧化硫的工业废气任意排放 | ||
| C. | 工业废水处理达标后再排放 | D. | 含磷洗衣粉的生活用水任意排放 |
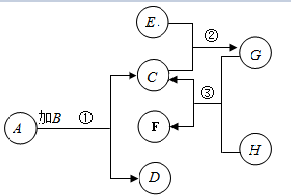 已知A,B,C,D,E,F,G,H是初中化学中常见的8中物质,其中B是黑色固体,D是紫红色固体,G不含碳元素,③不是复分解反应,相关物质在一定条件下转化关系如图:
已知A,B,C,D,E,F,G,H是初中化学中常见的8中物质,其中B是黑色固体,D是紫红色固体,G不含碳元素,③不是复分解反应,相关物质在一定条件下转化关系如图: