题目内容
 用来测定空气成分的方法很多,如图所示的是小明用红磷在空气中燃烧的测定方法.请回答下列问题:
用来测定空气成分的方法很多,如图所示的是小明用红磷在空气中燃烧的测定方法.请回答下列问题:(1)将燃烧匙中过量的红磷点燃后放入集气瓶中,能观察到的现象是
白磷燃烧,产生浓厚白烟
白磷燃烧,产生浓厚白烟
,反应的文字表达式为磷+氧气
五氧化二磷
| 点燃 |
磷+氧气
五氧化二磷
.| 点燃 |
(2)通过上述实验过程得出的实验结论为:空气中氧气约占总体积的
| 1 |
| 5 |
| 1 |
| 5 |
(3)根据实验你能得出氮气的物理性质是
无色、难溶于水
无色、难溶于水
.(4)实验完毕,若进入集气瓶中水的体积不到原有空气体积的
| 1 |
| 5 |
红磷不足
红磷不足
(写其中一个原因).分析:(1)根据白磷燃烧的现象及反应分析回答;
(2)根据实验时进入集气瓶内水的体积分析空气中氧气的体积分数;
(3)根据实验完成后红磷有剩余,而瓶内剩余的气体主要为氮气,由此可推断氮气的物理性质;
(4)根据测定空气中氧气体积分数实验的注意事项分析.
(2)根据实验时进入集气瓶内水的体积分析空气中氧气的体积分数;
(3)根据实验完成后红磷有剩余,而瓶内剩余的气体主要为氮气,由此可推断氮气的物理性质;
(4)根据测定空气中氧气体积分数实验的注意事项分析.
解答:解:(1)将燃烧匙中过量的红磷点燃后放入集气瓶中,能观察到的现象是白磷燃烧,产生浓厚白烟.白磷燃烧生成五氧化二磷,反应的文字表达式为:磷+氧气
五氧化二磷;
(2)通过上述实验过程可以看到进入集气瓶中水的体积约为集气瓶中原空气总体积的
,得出的实验结论为:空气中氧气约占总体积的
;
(3)由于集气瓶中进入水后剩余的气体主要是氮气,可以说明氮气的物理性质是:无色、难溶于水;
(4)实验完毕,若进入集气瓶中水的体积不到原有空气体积的
,可能的原因为:①红磷不足量;②装置的这气密性不好等.
故答为:(1)产生浓厚白烟,磷+氧气
五氧化二磷;(2)
;(3)无色、难溶于水;(4)红磷不足(或装置漏气、或没有冷却到室温就打开弹簧夹等).
| 点燃 |
(2)通过上述实验过程可以看到进入集气瓶中水的体积约为集气瓶中原空气总体积的
| 1 |
| 5 |
| 1 |
| 5 |
(3)由于集气瓶中进入水后剩余的气体主要是氮气,可以说明氮气的物理性质是:无色、难溶于水;
(4)实验完毕,若进入集气瓶中水的体积不到原有空气体积的
| 1 |
| 5 |
故答为:(1)产生浓厚白烟,磷+氧气
| 点燃 |
| 1 |
| 5 |
点评:通过回答本题要学会通过实验现象推实验结论的方法,由表面现象考虑本质特点再进一步推算物质的性质.

练习册系列答案
相关题目
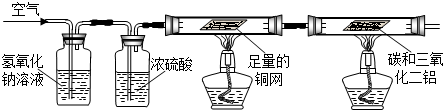
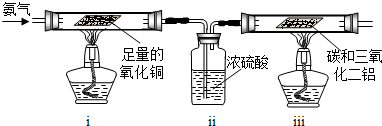
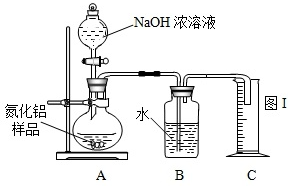
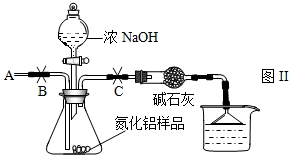
 NH3↑+CO2↑+H2O;②2NH3+H2SO4=(NH4)2SO4;③2NH3+3CuO
NH3↑+CO2↑+H2O;②2NH3+H2SO4=(NH4)2SO4;③2NH3+3CuO
