题目内容
 为了测定某铜锌合金中锌的质量分数,进行了如下实验:准确称取20.0g合金,向其中不断加入稀硫酸,观察到有气泡逸出,实验过程中测得产生气体的质量与所加稀硫酸的体积关系如图所示.回答下列问题:
为了测定某铜锌合金中锌的质量分数,进行了如下实验:准确称取20.0g合金,向其中不断加入稀硫酸,观察到有气泡逸出,实验过程中测得产生气体的质量与所加稀硫酸的体积关系如图所示.回答下列问题:
(1)计算铜锌合金中锌的质量分数.
(2)已知稀硫酸的密度为1g/ml,计算稀硫酸的溶质质量分数.(用V2来表示)
解:设铜锌合金中锌的质量是X,参加反应的硫酸溶质的质量是Y.
Zn+H2SO4═H2↑+ZnSO4
65 98 2
X Y 0.2g
 =
=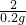
 =
=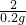
X=6.5g Y=9.8g
铜锌合金中锌的质量分数是: ×100%=32.5%
×100%=32.5%
锌与稀硫酸恰好反应时消耗的稀硫酸的体积为V2,则稀硫酸的溶质质量分数为: ×100%=
×100%= %
%
答:(1)铜锌合金中锌的质量分数是32.5%;
(2)稀硫酸的溶质质量分数是 %.
%.
分析:观察图象可知:合金中的锌最多反应生成氢气0.2g,依据氢气的质量结合方程式可以计算出锌的质量,硫酸溶质的质量,从而求出合金中锌的质量分数,稀硫酸的溶质质量分数.
点评:本题考查了学生分析图象获取信息及利用方程式解题的能力,解答时注意解题的规范性.
Zn+H2SO4═H2↑+ZnSO4
65 98 2
X Y 0.2g
 =
=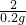
 =
=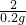
X=6.5g Y=9.8g
铜锌合金中锌的质量分数是:
 ×100%=32.5%
×100%=32.5%锌与稀硫酸恰好反应时消耗的稀硫酸的体积为V2,则稀硫酸的溶质质量分数为:
 ×100%=
×100%= %
%答:(1)铜锌合金中锌的质量分数是32.5%;
(2)稀硫酸的溶质质量分数是
 %.
%.分析:观察图象可知:合金中的锌最多反应生成氢气0.2g,依据氢气的质量结合方程式可以计算出锌的质量,硫酸溶质的质量,从而求出合金中锌的质量分数,稀硫酸的溶质质量分数.
点评:本题考查了学生分析图象获取信息及利用方程式解题的能力,解答时注意解题的规范性.

练习册系列答案
相关题目
为了测定某铜锌合金中锌的质量分数,某同学利用一定量的该合金与稀硫酸反应,进行了三次实验,相关的实验数据记录如下表.
(1)计算该铜锌合金中锌的质量分数.
(2)计算所用稀硫酸中溶质的质量分数.(结果精确到0.1%)
(可能用到的相对原子质量H-1 O-16 S-32 Cu-64 Zn-65)
| 实验 物质用量 |
第一次 | 第二次 | 第三次 |
| 所取合金的质量/g | 10 | 10 | 10 |
| 所用稀硫酸的质量/g | 50 | 100 | 150 |
| 剩余固体质量/g | 3.5 | 3.0 | 3.0 |
(2)计算所用稀硫酸中溶质的质量分数.(结果精确到0.1%)
(可能用到的相对原子质量H-1 O-16 S-32 Cu-64 Zn-65)
为了测定某铜锌合金中铜的质量分数,取合金样品跟稀盐酸反应.三次实验的有关数据如下表:
(1)根据上表中的数据分析,当铜锌合金中的锌与稀盐酸中的HCl恰好完全反应时,合金样品的质量与稀盐酸的质量之比为 .
(2)计算该铜锌合金中铜的质量分数. .
| 实验编号 | 所需合格样品的质量/g | 所取稀盐酸的质量/g | 生成氢气的质量/g |
| 1 | 10.0 | 40.0 | 0.1 |
| 2 | 10.0 | 50.0 | 0.1 |
| 3 | 20.0 | 36.5 | 0.1 |
(2)计算该铜锌合金中铜的质量分数.
 某研究小组为了测定某铜锌合金中铜的质量分数,取20g合金放在烧杯中,将一定量的稀盐酸分若干次加入烧杯中,反应过程的质量关系如下图所示(x表示加入稀盐酸的质量/g,y表示烧杯中余下物质的总质量/g).问:
某研究小组为了测定某铜锌合金中铜的质量分数,取20g合金放在烧杯中,将一定量的稀盐酸分若干次加入烧杯中,反应过程的质量关系如下图所示(x表示加入稀盐酸的质量/g,y表示烧杯中余下物质的总质量/g).问: 为了测定某铜锌合金中锌的质量分数,进行了如下实验:准确称取20.0g合金,向其中不断加入稀硫酸,观察到有气泡逸出,实验过程中测得产生气体的质量与所加稀硫酸的体积关系如图所示.回答下列问题:
为了测定某铜锌合金中锌的质量分数,进行了如下实验:准确称取20.0g合金,向其中不断加入稀硫酸,观察到有气泡逸出,实验过程中测得产生气体的质量与所加稀硫酸的体积关系如图所示.回答下列问题: