题目内容
某食盐水20 g,用蒸发皿蒸干后得到5 g食盐,则原食盐溶液中溶质的质量是________,溶剂的质量是________.
答案:5g,15g

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
 某制碱厂以岩盐水为主要原料生产纯碱(碳酸钠)和其他副产品.
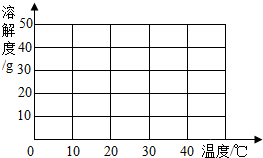
某制碱厂以岩盐水为主要原料生产纯碱(碳酸钠)和其他副产品.(一)原料岩盐水主要含氯化钠,此外还含有较多硫酸钠,以及少量氯化钙和氯化镁.上述几种物质在不同温度时的溶解度数据如下表:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | |
| 溶 | 氯化钠 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| 解 | 硫酸钠 | 4.5 | 9.6 | 20.2 | 40.8 | 48.4 |
| 度 | 氯化钙 | 59.5 | 65.0 | 74.5 | 100 | 116 |
| /g | 氯化镁 | 52.9 | 53.8 | 54.8 | 56.0 | 58.0 |
(二)岩盐水初步处理后,经净化、精制得到生产碳酸钠所需要的食盐水,同时制取副产品A晶体,其主要流程如下:
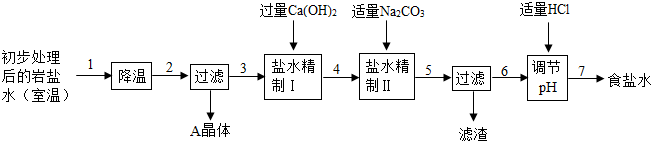
(1)“降温”的目的是析出副产品“A晶体”,它是
(2)“盐水精制I”中发生反应的化学方程式是
(3)“盐水精制Ⅱ中发生反应的化学方程式是
(4)经过上述精制过程中,仍有一种物质并没有能够完全除去,该物质可以在溶液精制过程中步骤
(三)用上述精制后的食盐水为原料生产的纯碱产品中会含有少量氯化钠杂质.该制碱厂的
产品包装袋上注明:碳酸钠含量≥96%.为测定该产品中含碳酸钠的质量分数,进行了以下实验:取18.0g纯碱样晶放入烧杯中,称得烧杯及所盛纯碱样品的总质量为158.Og,再把lOOg稀盐酸平均分成四份依次加入样品中,每次均充分反应.实验数据记录如下:
| 所加盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 盐酸的质量 | 25 | 25 | 25 | 25 |
| 烧杯及所盛物质总质量 | 180.3 | 202.6 | 226.4 | 251.4 |
(1)第一次加入稀盐酸充分反应后,生成二氧化碳的质量是
(2)该产品中碳酸钠的质量分数是否合格?(要求写出计算过程,结果精确到0.1%)
某制碱厂以岩盐水为主要原料生产纯碱(碳酸钠)和其他副产品.
(一)原料岩盐水主要含氯化钠,此外还含有较多硫酸钠,以及少量氯化钙和氯化镁.上述几种物质在不同温度时的溶解度数据如下表:
(1)根据所提供的溶解度数据,画出硫酸钠的溶解度曲线.
(2)10℃时由100g水配制得到的饱和硫酸钠溶液中溶质的质量是 g,溶质的质量分数是 (精确到0.1%).
(二)岩盐水初步处理后,经净化、精制得到生产碳酸钠所需要的食盐水,同时制取副产品A晶体,其主要流程如下: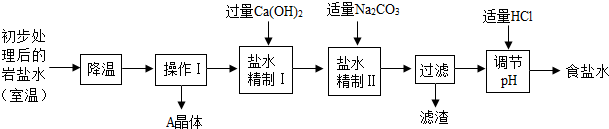
(3)“降温”的目的是析出副产品“A晶体”,A的化学式是 .
(4)“操作I”中的操作是 ,若在实验室进行该操作,需要用到的玻璃仪器除烧杯、玻璃棒外,还有 .
(5)“盐水精制I”是除去盐水中的少量氯化镁,反应的化学方程式是 .
(6)“盐水精制Ⅱ”是除去盐水中的其他杂质,反应的化学方程式是 .
(一)原料岩盐水主要含氯化钠,此外还含有较多硫酸钠,以及少量氯化钙和氯化镁.上述几种物质在不同温度时的溶解度数据如下表:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | |
| 溶解度/g | 氯化钠 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| 硫酸钠 | 4.5 | 9.6 | 20.2 | 40.8 | 48.4 | |
| 氯化钙 | 59.5 | 65.0 | 74.5 | 100 | 116 | |
| 氯化镁 | 52.9 | 53.8 | 54.8 | 56.0 | 58.0 | |
(2)10℃时由100g水配制得到的饱和硫酸钠溶液中溶质的质量是
(二)岩盐水初步处理后,经净化、精制得到生产碳酸钠所需要的食盐水,同时制取副产品A晶体,其主要流程如下:

(3)“降温”的目的是析出副产品“A晶体”,A的化学式是
(4)“操作I”中的操作是
(5)“盐水精制I”是除去盐水中的少量氯化镁,反应的化学方程式是
(6)“盐水精制Ⅱ”是除去盐水中的其他杂质,反应的化学方程式是
下列实验数据合理的是( )
| A.用pH试纸测得某地雨水的pH为5 |
| B.用10 mL量筒量取了6.53 mL水 |
| C.用20 g氯化钠和100 g水配制的120 g食盐水,其溶质质量分数为20% |
| D.用托盘天平称得某纯碱样品的质量为10.57 g |
