题目内容
【题目】如图为某化工企业生产流程示意图。下列说法正确的是
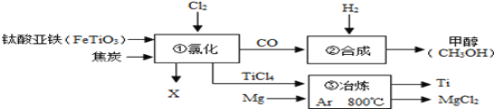
A.钛酸亚铁(FeTiO3)中钛元素为+3价
B.①中反应为:2FeTiO3+6C+7Cl2 2X+2TiCl4+6CO,则X为FeCl2
2X+2TiCl4+6CO,则X为FeCl2
C.③中为提高转化效率,可使用足量的金属镁
D.②中为使原料全部转化为甲醇,理论上CO和H2投料的质量比为7:1
【答案】D
【解析】
A、钛酸亚铁(FeTiO3)中,铁元素化合价是+2,氧元素化合价是-2,根据化合物中元素化合价代数和为零可知,钛元素化合价为+4价,故A错误;
B、由 可知,反应前后钛原子个数相等,氧原子个数相等,碳原子个数相等,反应前铁原子是2个,反应后应该是2个,反应前氯原子是14个,反应后应该是14个,因此2X中包含2个铁原子和6个氯原子,则X为FeCl3,故B错误;
可知,反应前后钛原子个数相等,氧原子个数相等,碳原子个数相等,反应前铁原子是2个,反应后应该是2个,反应前氯原子是14个,反应后应该是14个,因此2X中包含2个铁原子和6个氯原子,则X为FeCl3,故B错误;
C、③中应使用过量的金属镁,可使![]() 充分反应,提高转化效率,故C错误;
充分反应,提高转化效率,故C错误;
D、一氧化碳和氢气反应生成甲醇的化学方程式及其反应物之间的质量关系为:

为使原料全部转化为甲醇,理论上CO和H2投料的质量比为28:4=7:1,故D正确。
故选:D。

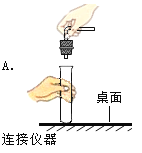
【题目】金属是现代生活和工业生产中应用极为普遍的一类材料。

(1)青少年看书、写字一定要爱护眼睛,台灯在光线不足时常用照明用具。图1中灯管后面的反光片为铝箔铝块能制成铝箔利用了铝的________性;
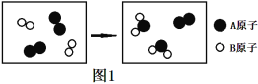
(2)Mg、Cu、Fe三种金属在稀盐酸里的反应现象如图2所示。图2中X所代表的金属是_______(填“Cu”或“Fe”);
(3)下列有关金属元素及其单质、化合物排列顺序正确的是___________;
AMn元素的化合价
B利用金属的年代:
C铜元素的质量分数
D元素的含量![]()
(4)金属的开发和利用是人类文明和社会进步的标志。美国普度大学研发出一种制备氢气的新工艺,流程如下图所示。

①此流程中,铝镓(Ga)合金________(填“可以”或“不可以”)循环使用;
②写出铝镓合金与水反应的化学方程式____________________。
(5)已知某金属粉末中除含有Al外还含有一定量的Fe和Cu,为证明Fe和Cu的存在并测定其中Al的质量分数,某化学兴趣小组的同学展开了如下的实验探究。
资料在线:Al与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气(反应的化学方程式为:2Al+2H2O+2NaOH=2NaAlO2+3H2↑),Fe和Cu不与氢氧化钠溶液反应。
①请完成证明金属粉末中存在Fe和Cu的实验设计:
实验操作 | 实验现象 | 结论 |
I.取少量的金属粉末于试管中,加入足量的氢氧化钠溶液 | _______________________ | 仅除去铝 |
II.将试管静置,弃去上层清液,加入足量的_____________(填试剂名称)。 | __________________________________ | 证明含有铁 |
III.将试管静置,弃去上层清液,多次洗涤剩余固体 | 剩余固体呈紫红色 | 证明含有铜 |
②为探究该金属粉末中Al的质量分数,取20 g该金属粉末,把100 g氢氧化钠溶液平均分成5份依次加入,充分反应后,过滤出固体,将其洗涤、干燥、称量。实验过程中得到的部分数据与图象如下:

加NaOH溶液的次数 | 第一次 | 第二次 | 第三次 | … |
剩余固体的质量/g | 1 7.3 | n | 11.9 | … |
I以上数据可知,上表中n的值为___________;
II该金属粉末中Al的质量分数为___________%
【题目】某校兴趣小组在实验室中完成制取氧气的实验。它们取氯酸钾和二氧化锰的混合物共3.0克放入大试管中加热,并在不同时刻测定试管内剩余固体物质的质量(如下表):
反应时间/min | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
剩余固体质量/g | 2.55 | 2.25 | 2.10 | 2.04 | 2.04 |
分析表中数据,完成下列问题:
(1)完全反应后,生成氧气多少克。
(2)原混合物中氯酸钾的质量分数是多少?