题目内容
【题目】有一固体混合物A,该混合物中可能含有BaCl2、Na2CO3、NaCl、CuCl2四种物质中的两种或多种.按如图所示进行实验,出现的线性如图所述(假设过程中所有可能发生的反应恰好都完全进行).
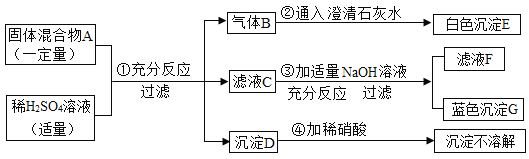
试根据实验过程和发生的现象做出判断,填写下列空白:
(1)沉淀D的化学式为_____;气体R的化学式为_____.
(2)滤液F中的溶质为_____.
(3)混合物A中不能确定含有的物质是_____.
(4)写出①汇总所发生反应的化学方程式:_____;_____.
【答案】BaSO4 CO2 Na2SO4、NaCl NaCl Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ BaCl2+H2SO4═BaSO4↓+2HCl
【解析】
稀硫酸能够和碳酸钠反应产生二氧化碳气体,二氧化碳能使澄清的石灰水变浑浊;利用C能够和氢氧化钠反应产生蓝色沉淀G,因此利用C中含有铜离子;不溶于稀硝酸的沉淀与硫酸根离子有关的是钡离子产生的硫酸钡沉淀;本题的解题突破口是固体混合物与硫酸混合生成使澄清石灰水变浑浊的气体,说明含碳酸钠;滤液与氢氧化钠反应生成了蓝色沉淀,说明含有CuCl2;沉淀D加稀硝酸不溶解,说明生成了硫酸钡,据此分析完成相关的问题.
(1)固体混合物与硫酸混合生成使澄清石灰水变浑浊的气体,说明含碳酸钠;滤液与氢氧化钠反应生成了蓝色沉淀,说明含有氯化铜;沉淀D加稀硝酸不溶解,说明生成了硫酸钡,则一定含有氯化钡;根据分析,沉淀D的化学式为 BaSO4;气体R的化学式为 CO2.
(2)因为碳酸钠溶液与稀硫酸反应生成硫酸钠、水和二氧化碳,氯化铜与氢氧化钠溶液反应生成氢氧化铜沉淀和氯化钠,故滤液F中的溶质为 Na2SO4、NaCl.
(3)混合物A中不能确定含有的物质是 NaCl.
(4)碳酸钠溶液与稀硫酸反应生成硫酸钠、水和二氧化碳,反应的化学方程式:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑.
氯化钡溶液与稀硫酸反应生成硫酸钡沉淀和盐酸,反应的化学方程式:BaCl2+H2SO4═BaSO4↓+2HCl.
故答案为:
(1)BaSO4; CO2.(2)Na2SO4、NaCl.(3)NaCl.(4)Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;BaCl2+H2SO4═BaSO4↓+2HCl.





