题目内容
某合金由两种金属元素组成,取该合金60g投入足量稀硫酸中,反应完全后,测得生成H2 3g,则合金的组成不可能是( )
A.Fe与Zn B.Mg与Cu C.Zn与Al D.Al与Fe
【考点】金属的化学性质;根据化学反应方程式的计算.
【专题】金属与金属材料.
【分析】利用一定质量金属完全反应放出氢气质量= ×金属质量,计算生0.2g氢气消耗选项所涉及金属铁、锌、铝的质量;然后根据题设的条件:两种金属混合物5.6g,与足量稀盐酸反应后生成0.2g氢气,推断出两种金属混合物的可能组成.
×金属质量,计算生0.2g氢气消耗选项所涉及金属铁、锌、铝的质量;然后根据题设的条件:两种金属混合物5.6g,与足量稀盐酸反应后生成0.2g氢气,推断出两种金属混合物的可能组成.
【解答】解:根据与稀硫酸反应时铁、锌、镁、铝分别呈+2、+2、+2、+3,与足量稀硫酸反应后生成了3g氢气,所需要消耗金属的质量分别为:
需要金属铁的质量=3g×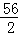 =84g;需要金属锌的质量3g×
=84g;需要金属锌的质量3g× g=97.5g;需要金属镁的质量=3g×
g=97.5g;需要金属镁的质量=3g×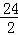 =36g;需要金属铝的质量=3g×
=36g;需要金属铝的质量=3g×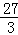 =27g;铜不能产生氢气;根据金属混合物与酸反应产生气体质量为两种金属反应产生氢气质量和,由实际实验中两种金属混合物60g与足量稀盐酸反应后生成了3g氢气,可判断选项混合物中两种金属不可能为铁和锌的混合物.
=27g;铜不能产生氢气;根据金属混合物与酸反应产生气体质量为两种金属反应产生氢气质量和,由实际实验中两种金属混合物60g与足量稀盐酸反应后生成了3g氢气,可判断选项混合物中两种金属不可能为铁和锌的混合物.
故选项为:A.
【点评】本题考查了金属与酸反应产生氢气的关系的计算,依据常见的总结公式一定质量金属完全反应放出氢气质量= ×金属质量进行计算或利用化学方程式进行计算或利用平均相对原子质量计算均可,需要注意到铁在与酸发生置换反应时呈现出+2价.
×金属质量进行计算或利用化学方程式进行计算或利用平均相对原子质量计算均可,需要注意到铁在与酸发生置换反应时呈现出+2价.

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案某元素是人体中的常量元素,它在人体内99%存在于骨
 |
骼和牙齿中。该元素的原子结构示意图为: ,则该元素的原子序数为 ,该原子核外有 个电子层,该元素属于 (填“金属”或“非金属”)元素,该元素在化合物中的常见化合价为 。


 B.
B.
 C.
C.
 D.
D.