题目内容
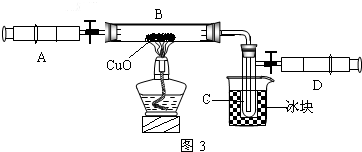
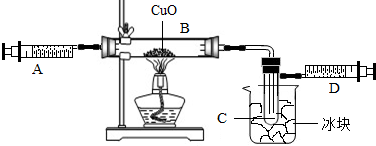
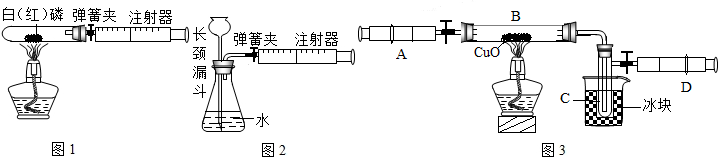
某学生为了测定由两种元素形成的气态化合物X的组成,做了如图所示的实验,把气体X由注射器A缓慢送入装有CuO的B装置,使之完全反应,得到如下结果:
实验前B管及药品的质量为21.32g,实验后为21.16g1C管中收集到的物质电解后可得到H2和O2,在D中收集到的是N2.2X中两元素的质量比是14:3.问:
(1)A的化学式是
(2)B中在实验中看到的现象是
(3)B中反应的化学方程式是
(4)向一充满A的铝制易拉罐中注入足量盐酸,并立即密封罐口,很快可以看到罐体变瘪了;但过一段时间后,瘪了的罐体又重新鼓起.试回答:
①罐体变瘪的原因是
②罐体重新鼓起的原因是
分析:由实验前B管及药品的质量为21.32g,实验后为21.16g1C管中收集到的物质电解后可得到H2和O2,在D中收集到的是N2,我们可以得到X含有氮、氢两种元素.然后根据2X中两元素的质量比是14:3.可以确定X的化学式.
解答:解:(1)由题意 我们可得X中含有氮、氧两种元素.又知2X中两元素的质量比是14:3.所以我们可得氮、氧两种元素的原子个数比为1:3.所以化学式为NH3.
C中收集到的水的质量为:(21.32g-21.16g)÷
×100%=0.18g
(2)氧化铜与氨气反应生成铜和水和氮气.所以现象为黑色固体逐渐变为红色.
(4)氨气是一种碱性气体,当加入盐酸时,氨气能与盐酸反应,使铝制易拉罐中压强变小,所以变瘪了.而剩余的盐酸能与铝反应生成氢气,所以过一段时间铝制易拉罐内的压强又变大了,所以又鼓起来.
故答案为:
(1)NH3;0.18.
(2)黑色固体变红色.
(3)2NH3+3CuO
3Cu+3H2O+N2
(4)①氨气被盐酸吸收,罐内压强减小
②剩余的盐酸继续跟铝反应生成氢气,使罐内压强增大
C中收集到的水的质量为:(21.32g-21.16g)÷
| 16 |
| 18 |
(2)氧化铜与氨气反应生成铜和水和氮气.所以现象为黑色固体逐渐变为红色.
(4)氨气是一种碱性气体,当加入盐酸时,氨气能与盐酸反应,使铝制易拉罐中压强变小,所以变瘪了.而剩余的盐酸能与铝反应生成氢气,所以过一段时间铝制易拉罐内的压强又变大了,所以又鼓起来.
故答案为:
(1)NH3;0.18.
(2)黑色固体变红色.
(3)2NH3+3CuO
| ||
(4)①氨气被盐酸吸收,罐内压强减小
②剩余的盐酸继续跟铝反应生成氢气,使罐内压强增大
点评:装置B中氧化铜变为铜,所以减少的质量为氧化铜中氧元素的质量,而氧元素又与氨气中的氢元素接合成水,所以水中氧元素的质量与水中氧元素的质量相等.从而求出水的质量.

练习册系列答案
相关题目