题目内容
12.硝酸铵(NH4NO3)受撞击或受热后产生爆炸性分解,可用作炸药.又因其含氮量比较高,也用作化学肥料.试计算:(1)NH4NO3的相对分子质量为80
(2)100g硝酸铵中含氮元素多少克?
分析 (1)根据相对分子的质量(式量)为组成分子的各原子的相对原子质量之和,进行分析解答.
(2)根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答.
解答 解:(1)根据相对分子的质量(式量)为组成分子的各原子的相对原子质量之和,可得硝酸铵的相对分子质量为14×2+4+16×3=80.故填:80;
(2)100克硝酸铵中含氮元素的质量为100g×$\frac{14×2}{80}×100%$=35g;故填:35g.
点评 本题难度不大,考查同学们灵活运用化学式的有关计算进行分析问题、解决问题的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.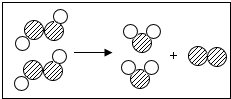 如图为某反应的微观示意图,不同的球代表不同幸免于难的原子,下列说法中错误的是( )
如图为某反应的微观示意图,不同的球代表不同幸免于难的原子,下列说法中错误的是( )
 如图为某反应的微观示意图,不同的球代表不同幸免于难的原子,下列说法中错误的是( )
如图为某反应的微观示意图,不同的球代表不同幸免于难的原子,下列说法中错误的是( )| A. | 该反应的反应物可能属于氧化物 | |
| B. | 不考虑反应条件时,该图示可以表示双氧水制取氧气的反应 | |
| C. | 该反应类型为分解反应 | |
| D. | 该反应前后元素的个数没有改变,分子的种类改变 |
 做空气中氧气含量测定的实验装置如右图.
做空气中氧气含量测定的实验装置如右图.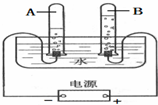 如图是电解水的实验装置图.电解水的反应符号表达式为2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,该反应属于基本反应类型中的分解反应.通过此实验说明水是由氢、氧两种元素组成的,同时也进一步说明在化学反应中,分子可以分解为原子,原子不能再分,只能重新组合.电解水一段时间后,试管B中收集到的气体是氧气,若B试管中最终收集到10mL气体,则A试管中最多可收集到20mL的气体.
如图是电解水的实验装置图.电解水的反应符号表达式为2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,该反应属于基本反应类型中的分解反应.通过此实验说明水是由氢、氧两种元素组成的,同时也进一步说明在化学反应中,分子可以分解为原子,原子不能再分,只能重新组合.电解水一段时间后,试管B中收集到的气体是氧气,若B试管中最终收集到10mL气体,则A试管中最多可收集到20mL的气体.