题目内容
2.如图为实验室常用的实验装置.回答问题:
从下列提供的仪器中进行选择,可以组装多套制取气体的装置,请回答有关问题.
(1)标号仪器的名称:⑥长颈漏斗.
(2)实验室用加热高锰酸钾制氧气,发生装置应从①-⑥中选择②③④⑤仪器组合(填编号).
(3)若要收集一瓶干燥的氧气,则收集装置可以选A(填字母A-C);
若D装置装满水用来收集氧气,气体应从n(填m或n)进.(4)使用①④⑥组合还可以制备CO2气体,反应方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑
小明对制备CO2的发生装置进行如图E的改造,该装置的优点是:可以控制反应的开始和停止
(5)某同学在实验室制备SO2气体,现要收集一瓶干燥的SO2气体,则F瓶中的液体是浓硫酸,且I瓶装的是NaOH的浓溶液,请你推测I装置的作用:吸收SO2,防止空气污染.并在F和H装置把导管补充完整(请在答题卡上画).

分析 (1)根据实验室常用仪器的名称和题中所指仪器的作用进行分析;
(2)根据实验室用高锰酸钾制取氧气的反应物是固体,反应条件是加热进行分析;
(3)根据排空气法收集的气体干燥,氧气密度比空气大,氧气密度比水小,不易溶于水进行分析;
(4)根据碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,E装置通过装置内压强的改变可以实现固体和液体的分离进行分析;
(5)根据浓硫酸具有吸水性,二氧化硫的密度比空气大,二氧化硫有毒,会污染空气,二氧化硫和氢氧化钠反应会生成亚硫酸钠和水进行分析.
解答 解:(1)通过分析题中所指仪器的作用可知,⑥是长颈漏斗;
(2)实验室用高锰酸钾制取氧气的反应物是固体,反应条件是加热,所以实验室用加热高锰酸钾制氧气,发生装置应从①-⑥中选择②③④⑤仪器组合;
(3)排空气法收集的气体干燥,氧气密度比空气大,所以要收集一瓶干燥的氧气,则收集装置可以选A,氧气密度比水小,不易溶于水,所以D装置装满水用来收集氧气,气体应从n进;
(4)碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑,E装置通过装置内压强的改变可以实现固体和液体的分离,所以对制备CO2的发生装置进行如图E的改造,该装置的优点是:可以控制反应的开始和停止;
(5)浓硫酸具有吸水性,二氧化硫的密度比空气大,二氧化硫有毒,会污染空气,二氧化硫和氢氧化钠反应会生成亚硫酸钠和水,所以要收集一瓶干燥的SO2气体,则F瓶中的液体是浓硫酸,且I瓶装的是NaOH的浓溶液,I装置的作用:吸收SO2,防止空气污染,洗气应该长进短出,所以F和H装置把导管如图: .
.
故答案为:(1)长颈漏斗;
(2)②③④⑤;
(3)A,n;
(4)CaCO3+2HCl═CaCl2+H2O+CO2↑,可以控制反应的开始和停止;
(5)浓硫酸,吸收SO2,防止空气污染, .
.
点评 本题主要考查常见气体的发生装置与收集装置的探究,发生装置依据反应物的状态和反应条件选择,收集装置依据气体的密度和溶解性选择.

 口算题天天练系列答案
口算题天天练系列答案
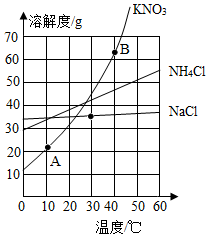
| A. | 依据溶解度曲线可判断,甲的溶解度比乙大 | |
| B. | 10℃时,甲、乙饱和溶液溶质的质量相同 | |
| C. | 20℃时,把30g甲放入50g水中形成的溶液中溶质质量分数为37.5% | |
| D. | 将20℃时的甲、乙饱和溶液升温至30℃,甲、乙溶液中溶质的质量分数均不变 |
| A. | NaOH和HCl | B. | HNO3和FeCl3 | C. | BaCl2和Na2SO4 | D. | KOH和CuSO4 |
(1)已知25℃时Ca(OH)2的溶解度为0.16g,则上述澄清石灰水的质量为4632.4g.
(2)向上述石灰水中通入CO2,当二者恰好完全反应生成碳酸钙沉淀时,通入CO2的质量是多少克?(写出计算过程)
(3)已知持续向饱和澄清石灰水中通入CO2,会发生反应CaCO3+H2O+CO2═Ca(HCO3)2,Ca(HCO3)2易溶于水.另取一定量的饱和澄清石灰水,通入一段时间的CO2,反应物与生成物的质量如表:
| 物质 | Ca(OH)2 | CO2 | CaCO3 | X | H2O |
| 质量/g | 14.8 | 13.2 | 10 | a | 1.8 |
| 选项 | 需区分的物质 | 方法一 | 方法二 |
| A | 氯化铵与硫酸铵 | 取样品,加熟石灰研磨 | 取样品溶于水,分别滴加氯化钡溶液 |
| B | 食盐与纯碱 | 取样品,分别滴加稀盐酸 | 取样品,分别滴加酚酞溶液 |
| C | 硬水与蒸馏水 | 取样品,分别加入肥皂水 | 取样品,分别蒸干 |
| D | 羊毛与涤纶 | 取样品,分别观察样色 | 取样品,分别点燃 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 液氢 | B. | 冰水混合物 | C. | 干冰 | D. | 生铁 |
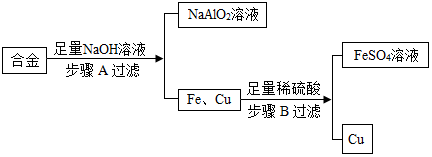
 酸、碱、盐是重要的化合物,研究它们的性质有重要意义.
酸、碱、盐是重要的化合物,研究它们的性质有重要意义.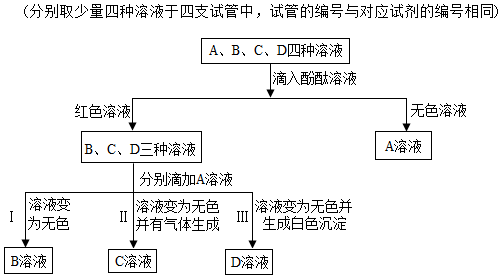
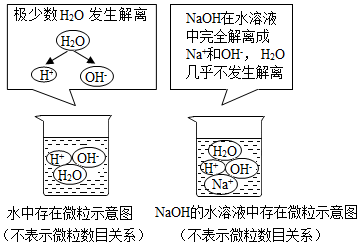
 硫酸钡不容易被X射线透过,在医疗上可用作检查肠胃的内服剂,俗称“钡餐”.小柯将硫酸镁溶液滴入硝酸钡[Ba(NO3)2]溶液中得到硫酸钡,如图表示该实验过程中溶液总质量随加入硫酸镁溶液质量的变化情况.图线AB段对应的实验现象是产生白色沉淀,C点处溶液中的溶质有Mg(NO3)2和MgSO4.
硫酸钡不容易被X射线透过,在医疗上可用作检查肠胃的内服剂,俗称“钡餐”.小柯将硫酸镁溶液滴入硝酸钡[Ba(NO3)2]溶液中得到硫酸钡,如图表示该实验过程中溶液总质量随加入硫酸镁溶液质量的变化情况.图线AB段对应的实验现象是产生白色沉淀,C点处溶液中的溶质有Mg(NO3)2和MgSO4.