题目内容
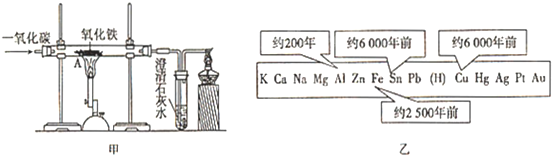
金属是一种重要的材料,人类的生活和生产都离不开金属.下图表示了金属活动性顺序表中铜、锡、铁和铝元素被人类大规模开发、利用的大致时间.
(1)根据图中数据和有关的化学知识,你认为金属大规模开发、利用的先后顺序跟下列哪些因素有关?
①地壳中金属元素的含量
②金属的导电性
③金属的活动性
④金属的延展性
⑤金属冶炼的难易程度
(2)钢铁的生产和使用是人类文明和社会进步的一个重要标志.请你写出一氧化碳在高温条件下把铁从赤铁矿(主要成分是氧化铁)里还原出来的化学方程式
(3)世界上每年钢铁的产量很高,但钢铁的锈蚀也给人类带来了巨大的损失.铁在空气中锈蚀,实际上是铁跟
(4)铝的活动性比铁强,但铝在空气中却表现出良好的抗腐蚀性,其原因是什么?
(5)若将13g锌放入100g稀硫酸溶液中恰好完全反应,则可生成氢气多少克?参加反应的稀硫酸中溶质的质量分数是多少?

(1)根据图中数据和有关的化学知识,你认为金属大规模开发、利用的先后顺序跟下列哪些因素有关?
③⑤
③⑤
.①地壳中金属元素的含量
②金属的导电性
③金属的活动性
④金属的延展性
⑤金属冶炼的难易程度
(2)钢铁的生产和使用是人类文明和社会进步的一个重要标志.请你写出一氧化碳在高温条件下把铁从赤铁矿(主要成分是氧化铁)里还原出来的化学方程式
3CO+Fe2O3
2Fe+3CO2
| ||
3CO+Fe2O3
2Fe+3CO2
.
| ||
(3)世界上每年钢铁的产量很高,但钢铁的锈蚀也给人类带来了巨大的损失.铁在空气中锈蚀,实际上是铁跟
水和氧气
水和氧气
等物质相互作用的结果.(4)铝的活动性比铁强,但铝在空气中却表现出良好的抗腐蚀性,其原因是什么?
(5)若将13g锌放入100g稀硫酸溶液中恰好完全反应,则可生成氢气多少克?参加反应的稀硫酸中溶质的质量分数是多少?
分析:根据已有的知识进行分析,金属越活泼冶炼的难度越大;一氧化碳能与氧化铁反应生成铁和二氧化碳;铁生锈的条件是与水和氧气同时接触;铝在空气中表面易形成致密的氧化铝保护膜;根据反应的化学方程式以及题干提供的数据进行计算即可.
解答:解:(1)金属大规模开发、利用的先后顺序与金属的活动性以及冶炼的难易有关,与金属的含量、导电性以及延展性无关;故填:③⑤;
(2)一氧化碳与氧化铁在高温条件下能反应生成铁和二氧化碳,故填:3CO+Fe2O3
2Fe+3CO2;
(3)铁生锈是铁与水和氧气同时接触,故填:水和氧气;
(4)铝在空气中表面易形成致密的氧化铝保护膜,起到了保护作用,故答案为:铝在空气中表面易形成致密的氧化铝保护膜;
(5)设生成氢气的质量为x,稀硫酸中硫酸的质量为y
Zn+H2SO4=ZnSO4+H2↑
65 98 2
13g y x
=
x=0.4g
=
y=19.6g
参加反应的稀硫酸中溶质的质量分数是:
×100%=19.6%
答:生成氢气的质量为0.4g,参加反应的稀硫酸中溶质的质量分数是19.6%.
(2)一氧化碳与氧化铁在高温条件下能反应生成铁和二氧化碳,故填:3CO+Fe2O3
| ||
(3)铁生锈是铁与水和氧气同时接触,故填:水和氧气;
(4)铝在空气中表面易形成致密的氧化铝保护膜,起到了保护作用,故答案为:铝在空气中表面易形成致密的氧化铝保护膜;
(5)设生成氢气的质量为x,稀硫酸中硫酸的质量为y
Zn+H2SO4=ZnSO4+H2↑
65 98 2
13g y x
| 65 |
| 13g |
| 2 |
| x |
| 65 |
| 13g |
| 98 |
| y |
参加反应的稀硫酸中溶质的质量分数是:
| 19.6g |
| 100g |
答:生成氢气的质量为0.4g,参加反应的稀硫酸中溶质的质量分数是19.6%.
点评:本题考查了金属活动性顺序及其应用以及金属锈蚀的条件和根据化学方程式的计算,完成此题,可以依据已有的知识结合题干提供的信息进行.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目