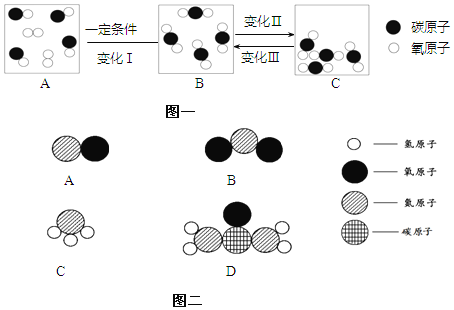
��Ŀ����
����Ŀ��ij��ѧ�о�С�������(��Ҫ��̼����Ԫ�����)ȼ�ս���������̽����

��1�����ͼ1��ʾʵ��,��ƿ�з�����Ӧ�Ļ�ѧ����ʽΪ_____;���Ʋ⿿����ͨ��_____(��Ͽڡ����¿ڡ�)�Ļ�����Ϩ��,������__________��
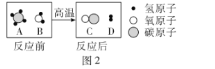
��2��ijͬѧ�ô��ձ����ߵ�2֧ȼ�յ�������ס(��ͼ2��ʾ),�۲쵽�ߵ�������Ϩ��,�͵������Ϩ��
��������⣩���¸ߵ�������Ϩ���ԭ����ʲô?
����������裩����1:�����Ǹ�������渽���Ķ�����̼Ũ�ȹ��ߵ�������Ϩ��;
����2:�����Ǹ�������渽��������Ũ�ȹ��͵�������Ϩ��
�����ʵ�飩��ͬѧ��ͼ2װ�ý���ʵ��,��ȼ����,�ô��ձ���ס��һ��ʱ���,���������ձ����ϲ�����ֽ������ɫ(ʯ��ˮ��ʹ��̪���,̼��Ʋ���ʹ��̪���),˵����ʱ�������Ķ�����̼Ũ�ȱȵ������Ķ�����̼Ũ��_____(��ߡ��͡�)��
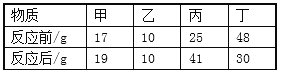
��3��Ϊ��һ����֤����1,��ͬѧ�ռ�һƿ��20%������80%������̼������,����ȼ��������������ƿ�в��ܱ�,����ȼ��һ��ʱ�������Ϩ��,����ʵ�������֪,����1_____(���������������),ԭ����___________��
��4����ͬѧʹ�ô���������ܱ�װ���������ȼ�յ�Ϩ��Ĺ�����(80 sʱ����Ϩ��),װ���������Ͷ�����̼�����ı仯������ͼ3����ɵó�����ȼ�յ�������______

��5���������֪ʶ������ʵ�����,��ͬѧ��ʵ����,������ȫϨ���ƿ�ں��е�������_____ (����������)��
���𰸡�CaCO3+2HCl=CaCl2+H2O+CO2�� �� ������̼���ܶȱȿ������Ҳ�֧��ȼ�� �� ������ ������̼��Ũ�Ⱥܸ�ʱ,��������ȼ��һ��ʱ�� ���������Ũ�Ȳ��ܵ���16% ������̼��������ˮ������һ����̼��
��������
��1��ʯ��ʯ����Ҫ�ɷ���̼��ƣ������ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼����Ӧ�Ļ�ѧ����ʽΪ��CaCO3+2HCl=CaCl2+H2O+CO2����������̼���ܶȱȿ�����ȼ�ա�Ҳ��֧��ȼ�գ����Կ�����ͨ���¿ڵĻ�����Ϩ��
��2��ʯ��ˮ�Լ��ԣ���ʹ��ɫ�ķ�̪��Һ���ɫ��������̼�����������Ʒ�Ӧ����̼��Ƴ�����ˮ����ʵ�����һ��ʱ����������ձ����ϲ�����ֽ����ɫ��˵����ʱ�������Ķ�����̼Ũ�ȱȵ�������Ũ�ȸߣ�
��3���ռ�1ƿ��20%������80%������̼�����壬����ȼ��������������ƿ�в��ܱգ�����ȼ��һ��ʱ�������Ϩ�𣬸�����һ�����֪������1��������
��4����ͼ���е����ݿ�֪��ȼ�չ�����������Ũ�Ƚ��ͣ���������Ũ�ȵ���16%��80s��ʱ������Ϩ���ˣ���˵��������ȼ����Ҫ������Ũ�Ȳ��ܵ���16%��
��5������ȼ�������˶�����̼��ˮ��������ͼ���֪������Ϩ���װ���ڻ�����������������������ȫϨ���ƿ�ں��ж�����̼��������һ����̼��ˮ������

����Ŀ����һ��ʯ��ʯ��Ʒ�ijɷ���CaCO3��SiO2(��֪SiO2�Ȳ�����ˮҲ�������ᷴӦ)������С��Ϊ�˲ⶨ��ʯ��ʯ��Ʒ��̼��Ƶ�������������һ������ʯ��ʯ��Ʒ�����ձ��У��ٽ�100 gϡ�����4�μ����ձ��У�ÿ�ξ���ַ�Ӧ��ʵ�����ݼ�¼���£�
���� | ��һ�� | �ڶ��� | ������ | ���Ĵ� |
����ϡ���������/g | 25 | 25 | 25 | 25 |
��Ӧ���ձ������ʵ�������/g | 35.2 | 58.4 | 82.6 | 107.6 |
(1)��1�μ���ϡ�����ַ�Ӧ�����ɶ�����̼��������
(2)��ʯ��ʯ��Ʒ��̼��Ƶ�������