题目内容
(3分)化学小组同学取某黄铜(铜和锌的合金)样品进行如下实验,他们取该黄铜样品碎屑50g,把200g稀硫酸分4次加入到该样品中,测得数据记录如下表:
|
|
第1次 |
第2次 |
第3次 |
第4次 |
|
加人稀硫酸质量/g |
50 |
50 |
50 |
50 |
|
剩余固体质量/g |
43.5 |
37.0 |
33.75 |
33.75 |
(1) 当加入稀硫酸的质量为 g时,反应恰好完成。
(2) 计算生成氢气的总质量(写出计算过程)。
(3分)
⑴ 125
----------------------------------------------- -----------------(1分)
-----------------(1分)
(2) 解:设生成氢气的总质量为x
Zn + H2SO4 == ZnSO4 + H2↑
65 2
(50-33.75)g x --------------------------(1分)
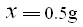 ---------------------------------------------(1分)
---------------------------------------------(1分)
答:生成氢气的总质量为0.5g。
【解析】略

| 第1次 | 第2次 | 第3次 | 第4次 | |
| 加入稀硫酸质量/g | 50 | 50 | 50 | 50 |
| 剩余固体质量/g | 43.5 | 37.0 | 33.75 | 33.75 |
(2)计算生成氢气的总质量(写出计算过程).
(3分)化学小组同学取某黄铜(铜和锌的合金)样品进行如下实验,他们取该黄铜样品碎屑50g,把200g稀硫酸分4次加入到该样品中,测得数据记录如下表:
|
| 第1次 | 第2次 | 第3次 | 第4次 |
| 加人稀硫酸质量/g | 50 | 50 | 50 | 50 |
| 剩余固体质量/g | 43.5 | 37.0 | 33.75 | 33.75 |
(1) 当加入稀硫酸的质量为 g时,反应恰好完成。
(2) 计算生成氢气的总质量(写出计算过程)。
| | 第1次 | 第2次 | 第3次 | 第4次 |
| 加人稀硫酸质量/g | 50 | 50 | 50 | 50 |
| 剩余固体质量/g | 43.5 | 37.0 | 33.75 | 33.75 |
(2) 计算生成氢气的总质量(写出计算过程)。
化学小组同学取某黄铜(铜和锌的合金)样品进行如下实验,他们取该黄铜样品碎屑50g,把200g稀硫酸分4次加入到该样品中,测得数据记录如下表:
| 第1次 | 第2次 | 第3次 | 第4 | |
| 加人稀硫酸质量/g | 50 | 50 | 50 | 50 |
| 剩余固体质量/g | 43.5 | 37.0 | 33.75 | 33.75 |
(1) 当加入稀硫酸的质量为 g时,反应恰好完成。
(2) 计算生成氢气的总质量(写出计算过程)。
