题目内容
一定温度下,欲将200g的NH4Cl饱和溶液改变溶质质量分数,下列做法可行的是( )解答:解:A、向NH4Cl饱和溶液中加入10g的NH4Cl,所加固体物质不能继续溶解,因此也就不能改变饱和溶液的组成;故A不可行;
B、向NH4Cl饱和溶液中加入10g的水,溶剂质量增加而溶液中溶质质量不变,所得溶液的溶质质量分数会减小;故B可行;
C、对200g的NH4Cl饱和溶液蒸发掉10g的水,蒸发水溶质NH4Cl同时减少,溶液中溶质与溶剂的比不变仍为饱和溶液,不能改变溶液的溶质质量分数;故C不可行;
D、溶液具有均一稳定性,外界条件不变放置不能改变溶液的组成;故D不可行;
故选B.
点评:根据饱和溶液不能继续溶解溶质、恒温蒸发溶剂时溶质随之析出而不改变溶液的饱和状态、均一稳定等特点,判断所设计方案对饱和溶液的影响.

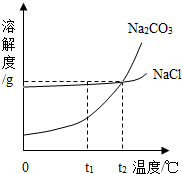 我国某地区有一种“冬天捞碱,夏天晒盐”的传统.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中会含有少量NaCl.下图为Na2CO3和NaCl的溶解度曲线和部分温度下的溶解度表(单位是克),看图回答下列问题:
我国某地区有一种“冬天捞碱,夏天晒盐”的传统.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中会含有少量NaCl.下图为Na2CO3和NaCl的溶解度曲线和部分温度下的溶解度表(单位是克),看图回答下列问题:(1)①t1℃时,NaCl的溶解度
②“冬天捞碱”的原因是由于Na2CO3的溶解度随温度降低而
③“夏天晒盐”是利用
A.利用风吹日晒,使溶剂蒸发 B.升高温度,使NaCl溶解度增大
(2)根据下表分析:
| 温度 物质 |
0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2CO3 | 7.0 | 12.5 | 21.5 | 39.0 | 49.0 |
②下列几种说法中,正确的是
A.碳酸钠晶体的溶解度受温度影响较大
B.将含水各1OOg的氯化钠与碳酸钠的饱和溶液,从30℃降至O℃,析出晶体的质量相等 C.t2对应的温度在2O℃-30℃之间
D.欲从含有少量NaCl杂质的碳酸钠浓溶液中分离出碳酸钠晶体,应采取降低溶液温度的方式.
下表是KNO3、NaCl在不同温度下的溶解度:
| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| KNO3 | 13.3 | 20.9 | 32 | 45.8 | 64 | 85.5 | 110 | 138 | 169 | 202 | 246 |
| NaCl | 35.7 | 35.8 | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
(1)KNO3溶液中含有少量NaCl时,可通过________的方法提纯。
(2)对(1)析出的晶体和剩余溶液描述正确的是________(填写编号)。
A.剩余溶液一定是KNO3饱和溶液 B.剩余溶液一定是NaCl不饱和溶液
C.上述方法可以将两者完全分离 D.析出的晶体中只含有KNO3
(3)在一定温度下,将含69gKNO3、18gNaCl的混合物完全溶解在50g水中。欲改变温度使KNO3析出,NaCl不析出,则温度T(℃)的范围是________℃(硝酸钾和氯化钠溶解度互不影响)。
下表是KNO3、NaCl在不同温度下的溶解度:
|
温度(℃) |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
|
KNO3 |
13.3 |
20.9 |
32 |
45.8 |
64 |
85.5 |
110 |
138 |
169 |
202 |
246 |
|
NaCl |
35.7 |
35.8 |
36 |
36.3 |
36.6 |
37 |
37.3 |
37.8 |
38.4 |
39 |
39.8 |
(1)KNO3溶液中含有少量NaCl时,可通过________的方法提纯。
(2)对(1)析出的晶体和剩余溶液描述正确的是________(填写编号)。
A.剩余溶液一定是KNO3饱和溶液 B.剩余溶液一定是NaCl不饱和溶液
C.上述方法可以将两者完全分离 D.析出的晶体中只含有KNO3
(3)在一定温度下,将含69gKNO3、18gNaCl的混合物完全溶解在50g水中。欲改变温度使KNO3析出,NaCl不析出,则温度T(℃)的范围是________℃(硝酸钾和氯化钠溶解度互不影响)。