题目内容
同学从山上采集到一种石灰石(主要万分是碳酸钙).他们取80克该样品进行煅烧实验(杂质不变化),测得反应后固体的质量(m)与反应时间(t)的关系如表:
| 反应时间t/s | 0 | 3 | 5 | 7 | 8 | 9 | 10 |
| 反应后固体的质量m/g | 80 | 75 | 70 | 66 | 62 | 58 | 58 |
(1)当石灰石完全反应后,生成CO2的质量为 22 g.
(2)该石灰石中CaCO3的质量分数是多少?提示:碳酸钙在高温煅烧时分解,反应的化学方程式为:CaCO3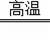
 CaO+CO2↑
CaO+CO2↑
【考点】根据化学反应方程式的计算.
【分析】高温条件下,碳酸钙分解生成氧化钙和二氧化碳,反应前后的质量差即为反应生成二氧化碳的质量,根据二氧化碳质量可以计算碳酸钙的质量,进一步可以计算碳酸钙的质量分数.
【解答】解:(1)当石灰石完全反应后,生成CO2的质量为:80g﹣58g=22g,
故填:22.
(2)设碳酸钙质量为x,
CaCO3
 CaO+CO2↑,
CaO+CO2↑,
100 44
x 22g

 =
=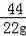
 ,
,
x=50g,
该石灰石中CaCO3的质量分数是: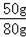
 ×100%=62.5%,
×100%=62.5%,
答:该石灰石中CaCO3的质量分数是62.5%.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
根据反应事实可以推出影响化学反应的因素,下列推理中不合理的是( )
| 选项 | 化学反应事实 | 影响因素 |
| A | 蜡烛在纯氧中燃烧的火焰比在空气中燃烧的火焰更明亮 | 反应物浓度 |
| B | 煤粉比煤块燃烧的更加剧烈、更加充分 | 反应物种类 |
| C | 碳在常温下不与氧气反应,点燃时能与氧气反应 | 反应温度 |
| D | 双氧水在通常情况下难分解,加入二氧化锰后迅速分解 | 催化剂 |
A.A B.B C.C D.D
 B.
B.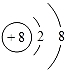 C.
C.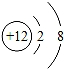 D.
D.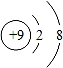
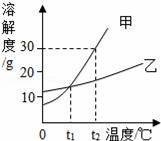


 B.
B.
 C.
C.
 D.
D.
