题目内容
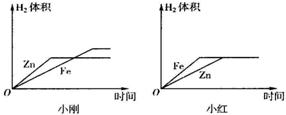
 有等质量的镁和锌,前者放入质量分数为10%的稀盐酸中,后者放入质量分数为10%的稀硫酸中,产生氢气的质量随时间变化曲线如如图所示.下列说法正确的是________.
有等质量的镁和锌,前者放入质量分数为10%的稀盐酸中,后者放入质量分数为10%的稀硫酸中,产生氢气的质量随时间变化曲线如如图所示.下列说法正确的是________.
A、锌一定没有剩余
B、消耗的稀盐酸和稀硫酸质量之比为73:98
C、Zn、Mg与酸反应的速率为Zn>Mg
D、消耗镁的质量与消耗锌的质量之比为________.
B 24:65
分析:本题属于开放性选择题,既选择一个正确的答案,然后再写一个正确的答案.根据题目给出的信息和图象可以得出产生氢气的量一样多,可以判断出两种金属中有一种剩余,然后根据金属与酸反应存在的关系式M~H2可判断出消耗酸和金属的质量的大小关系,即24:65.再根据金属与酸反应存在的关系式,求酸的质量比.
解答:A、等质量的不同金属得到的氢气一样多,说明参与反应的金属的质量一定不一样多,因此至少有一种金属剩余,由M~H2可知,相对原子质量小的金属有剩余,则镁有剩余,锌可能有剩余,也可能没有剩余,故A错误;
B、由于得到的氢气一样多,根据元素的质量守恒可知,参加反应的稀盐酸和稀硫酸的溶质中氢元素的质量一定相等,则2HCl~2H~H2SO4,稀盐酸和稀硫酸质量之比为36.5×2:98=73:98,故B正确;
C、根据金属的活动性顺序,镁比锌活泼,因此镁的反应速率快,故C错误;
D、本选项是补充一个正确的答案,根据金属与酸反应存在的关系式M~H2可判断出消耗酸和金属的质量的大小关系,即24:65.
故选B.补充:消耗镁的质量与消耗锌的质量之比为 24:65
点评:本考点考查了根据化学方程式的计算和金属的化学性质,属于溶质的质量分数和化学方程式的综合应用,是中考计算题中经常出现的题型.做题时要注意:化学方程式要写正确,要注意配平.本考点主要出现在选择题和计算题中.
分析:本题属于开放性选择题,既选择一个正确的答案,然后再写一个正确的答案.根据题目给出的信息和图象可以得出产生氢气的量一样多,可以判断出两种金属中有一种剩余,然后根据金属与酸反应存在的关系式M~H2可判断出消耗酸和金属的质量的大小关系,即24:65.再根据金属与酸反应存在的关系式,求酸的质量比.
解答:A、等质量的不同金属得到的氢气一样多,说明参与反应的金属的质量一定不一样多,因此至少有一种金属剩余,由M~H2可知,相对原子质量小的金属有剩余,则镁有剩余,锌可能有剩余,也可能没有剩余,故A错误;
B、由于得到的氢气一样多,根据元素的质量守恒可知,参加反应的稀盐酸和稀硫酸的溶质中氢元素的质量一定相等,则2HCl~2H~H2SO4,稀盐酸和稀硫酸质量之比为36.5×2:98=73:98,故B正确;
C、根据金属的活动性顺序,镁比锌活泼,因此镁的反应速率快,故C错误;
D、本选项是补充一个正确的答案,根据金属与酸反应存在的关系式M~H2可判断出消耗酸和金属的质量的大小关系,即24:65.
故选B.补充:消耗镁的质量与消耗锌的质量之比为 24:65
点评:本考点考查了根据化学方程式的计算和金属的化学性质,属于溶质的质量分数和化学方程式的综合应用,是中考计算题中经常出现的题型.做题时要注意:化学方程式要写正确,要注意配平.本考点主要出现在选择题和计算题中.

练习册系列答案
相关题目