题目内容
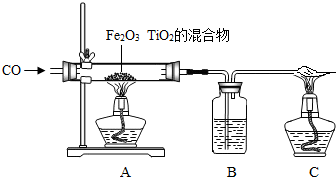
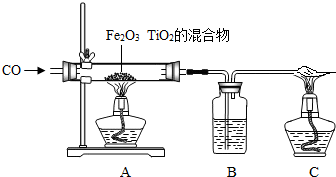
高温时,用足量CO还原11.52gFeO和Fe2O3,将产生的CO2通入澄清石灰水中,得到18.8g沉淀,则混合物中FeO的质量分数为( )
| A、25% | B、50% | C、60% | D、75% |
分析:由产生的沉淀的质量可得到CO2的质量,又因为有FeO和Fe2O3的总质量,然后利用FeO和Fe2O3分别和CO的反应列方程组求解即可得到FeO的质量,进而得到FeO的质量分数.
解答:解:设CO2的质量为x
CO2+Ca(OH)2═CaCO3↓+H2O
44 100
x 18.8g
=
x=8.27g
设FeO的质量为y,由FeO产生的质量为z
CO+FeO
Fe+CO2
72 44
y z
=
①
3CO+Fe2O3
2Fe+3CO2
160 3×44
11.52g-y 8.27g-z
=
②
由①②两个方程式列方程组求解可得:y=5.77g
所以混合物中FeO的质量分数为:
×100%=50%
故选B
CO2+Ca(OH)2═CaCO3↓+H2O
44 100
x 18.8g
| 44 |
| 100 |
| x |
| 18.8g |
x=8.27g
设FeO的质量为y,由FeO产生的质量为z
CO+FeO
| ||
72 44
y z
| 72 |
| 44 |
| y |
| z |
3CO+Fe2O3
| ||
160 3×44
11.52g-y 8.27g-z
| 160 |
| 3×44 |
| 11.52g-y |
| 8.27g-z |
由①②两个方程式列方程组求解可得:y=5.77g
所以混合物中FeO的质量分数为:
| 5.77g |
| 11.52g |
故选B
点评:此题是利用化学方程式的计算,此题解题思路明确,比较容易想到,但计算过程比较麻烦,很好的练习了学生们的计算能力.

练习册系列答案
相关题目
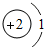 D.原子结构示意图为
D.原子结构示意图为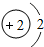
 (2013?江西模拟)“嫦娥一号”的成功发射,使全国人民欢欣鼓舞.请同学们阅读下列航天技术中的化学短文并回答有关问题.
(2013?江西模拟)“嫦娥一号”的成功发射,使全国人民欢欣鼓舞.请同学们阅读下列航天技术中的化学短文并回答有关问题.