题目内容
 化学兴趣小组测定某石灰石样品中碳酸钙的质量分数,其方法是:将样品与盐酸反应,测定反应后生成的CO2质量,再根据CO2的质量求出样品中碳酸钙的质量.
化学兴趣小组测定某石灰石样品中碳酸钙的质量分数,其方法是:将样品与盐酸反应,测定反应后生成的CO2质量,再根据CO2的质量求出样品中碳酸钙的质量.
(1)为测定CO2的质量,他们想出了以下a、b、c三种方案,请填空以帮助他们完成设计方案:
a.可称量反应前后物质总质量的减小量.
b.可称量吸收CO2前后盛有氢氧化钠溶液容器质量的________(选填“增大”或“减小”)量.
c.选用右图________装置可测量产生的CO2的________,再利用此时CO2的________,可计算CO2的质量.图中瓶内水面上油层的作用是________.
增大 甲 体积 密度 阻止二氧化碳与水反应
分析:b.氢氧化钠溶液吸收反应放出的二氧化碳生成碳酸钠,根据质量守恒定律,可判断溶液质量增大;
c.对比两装置中导管的位置,判断可测定二氧化碳气体的装置;
根据测定的体积,使用体积与质量关系式可计算出其质量;其中油层可防止二氧化碳气体被水所消耗.
解答:b、根据质量守恒定律,氢氧化钠溶液因吸收二氧化碳而质量增大;
c、乙图装置使二氧化碳通过水中,不能测得二氧化碳的量,故应选用甲装置测定放出二氧化碳气体的体积;利用二氧化碳气体的密度可计算出二氧化碳的质量;
装置中的油层可防止二氧化碳与水接触而消耗二氧化碳;
故答案为:增大;甲;体积;密度;阻止二氧化碳与水反应.
点评:根据实验的目的及对实验的描述或实验装置图的分析,明确实验的过程及操作方法,是解决此类实验型问题的突破口.
分析:b.氢氧化钠溶液吸收反应放出的二氧化碳生成碳酸钠,根据质量守恒定律,可判断溶液质量增大;
c.对比两装置中导管的位置,判断可测定二氧化碳气体的装置;
根据测定的体积,使用体积与质量关系式可计算出其质量;其中油层可防止二氧化碳气体被水所消耗.
解答:b、根据质量守恒定律,氢氧化钠溶液因吸收二氧化碳而质量增大;
c、乙图装置使二氧化碳通过水中,不能测得二氧化碳的量,故应选用甲装置测定放出二氧化碳气体的体积;利用二氧化碳气体的密度可计算出二氧化碳的质量;
装置中的油层可防止二氧化碳与水接触而消耗二氧化碳;
故答案为:增大;甲;体积;密度;阻止二氧化碳与水反应.
点评:根据实验的目的及对实验的描述或实验装置图的分析,明确实验的过程及操作方法,是解决此类实验型问题的突破口.

练习册系列答案
相关题目
 金属是现代生活和工业生产中应用极为普遍的一类材料.
金属是现代生活和工业生产中应用极为普遍的一类材料.(1)已知在相同的条件下,金属的活动性越强,金属和酸反应产生气泡(氢气)的速度就越快.Al、Cu、Fe三种金属在稀盐酸里的反应现象如右图所示.
①右图中Y所代表的金属是
②Al、Cu、Fe三种金属的活动性由强到弱的顺序为
③铝是一种活泼金属,但常温下铝却有较强的抗腐蚀性,其原因是
(2)金属的开发和利用是人类文明和社会进步的标志.
①我国古代将炉甘石(ZnCO3)、赤铜矿(Cu2O)和木炭粉混合加热至800℃左右,即可得到与黄金外观相似的“药金”.
I.用上述方法不能制得真正的黄金(Au)是因为
II.“药金”是
②钛因常温下不与酸、碱反应等优良的性能,被誉为“未来金属”.由钒钛磁铁矿提取金属钛的主要工艺过程如下:
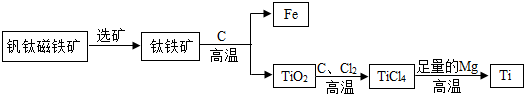
在高温下与足量Mg反应置换生成金属Ti,该反应的化学方程式为:
上述生产过程中得到的金属钛中混有少量金属杂质,可加入
(3)已知某金属粉末中除含有Al外还含有一定量的Fe和Cu,为证明Fe和Cu的存在并测定其中Al的质量分数,某化学兴趣小组的同学展开了如下的实验探究.
资料在线:Al与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气(反应的化学方程式为:2Al+2H2O+2NaOH=2NaAlO2+3H2↑),Fe和Cu不与氢氧化钠溶液反应.
①请完成证明金属粉末中存在Fe和Cu的实验设计:
| 实验操作 | 实验现象 | 结论 |
| Ⅰ取少量的金属粉末于试管中,加入足量的 |
仅除去铝 | |
| Ⅱ将试管静置,弃去上层清液,加入足量的稀硫酸. | 证明含有铁 | |
| Ⅲ将试管静置,弃去上层清液,多次洗涤剩余固体 | 剩余固体呈紫红色 | 证明含有铜 |
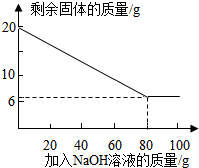 ②为探究该金属粉末中Al的质量分数,取20 g该金属粉末,把100 g氢氧化钠溶液平均分成5份依次加入,充分反应后,过滤出固体,将其洗涤、干燥、称量.实验过程中得到的部分数据与图象如下:
②为探究该金属粉末中Al的质量分数,取20 g该金属粉末,把100 g氢氧化钠溶液平均分成5份依次加入,充分反应后,过滤出固体,将其洗涤、干燥、称量.实验过程中得到的部分数据与图象如下:| 加NaOH溶液的次数 | 第一次 | 第二次 | 第三次 | … |
| 剩余固体的质量/g | 16.5 | n | 9.5 | … |
Ⅱ.该金属粉末中Al的质量分数为
Ⅲ.列式计算:所用氢氧化钠溶液的溶质质量分数为多少?
 (2012?昌平区一模)氯化钙钾石的化学式为KCl?xCaCl2(x是CaCl2的系数).它是一种钾肥,溶于水后得到KCl和CaCl2的混合溶液.某化学兴趣小组为了测定氯化钙钾石中钾元素的质量分数,称取样品18.55g加水完全溶解得到KCl与CaCl2的混合溶液210g,向该溶液中逐滴加入Na2CO3溶液,产生的沉淀与加入Na2CO3溶液的质量关系如图所示.已知:Na2CO3+CaCl2═CaCO3↓+2NaCl,请计算:
(2012?昌平区一模)氯化钙钾石的化学式为KCl?xCaCl2(x是CaCl2的系数).它是一种钾肥,溶于水后得到KCl和CaCl2的混合溶液.某化学兴趣小组为了测定氯化钙钾石中钾元素的质量分数,称取样品18.55g加水完全溶解得到KCl与CaCl2的混合溶液210g,向该溶液中逐滴加入Na2CO3溶液,产生的沉淀与加入Na2CO3溶液的质量关系如图所示.已知:Na2CO3+CaCl2═CaCO3↓+2NaCl,请计算:
 (2013?长清区一模)为测定某赤铁矿石中氧化铁的质量分数,某化学兴趣小组的同学用过量的一氧化碳与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用100g氢氧化钠溶液恰好完全吸收,形成不饱和溶液.该溶液总质量与反应时间的变化关系如图.试分析解答:
(2013?长清区一模)为测定某赤铁矿石中氧化铁的质量分数,某化学兴趣小组的同学用过量的一氧化碳与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用100g氢氧化钠溶液恰好完全吸收,形成不饱和溶液.该溶液总质量与反应时间的变化关系如图.试分析解答: