题目内容
【10桂林32】.课外活动小组的同学在测定由NaCl和Na2CO3形成的固体混合物组成时,进行了以下实验:取40 g固体混合物配成溶液,平均分为四份,然后分别加入一定质量分数的CaCl2溶液,实验数据见下表:
|
|
实验一 |
实验二 |
实验三 |
实验四 |
|
原固体混合物质量 |
10g |
10g |
10g |
10g |
|
加入CaCl2溶液质量 |
10g |
20g |
30g |
40g |
|
生成的沉淀的质量 |
2g |
m |
5g |
5g |
请分析表中数据回答并计算[(4)要求写计算过程 ]
(1)生成的沉淀是(填写化学式) 。
(2)10g原固体混合物配成的溶液和足量CaCl2溶液反应,最多生成沉淀质量为 g。
(3)m= g。
(4)原固体混合物中Na2CO3的质量分数是多少?
解:(1)CaCO3 (1分) (2)5 (2分) (3) 4 (2分)
(4)设10g原固体混合物中Na2CO3质量为x
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
106 100
x 5g …………………………………………… (1分)
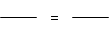 106 100
106 100
x 5g ………………………………………… (1分)
x = 5.3g ……………………………………… (1分)
固体混合物中Na2CO3的质量分数是:
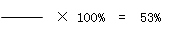 5.3g
5.3g
10g …………… (2分 ,列式和结果各1分)
答:原混合物中碳酸钠的质量分数是53%。
(合理解答参照给分)
【解析】略

 春雨教育同步作文系列答案
春雨教育同步作文系列答案【10桂林32】.课外活动小组的同学在测定由NaCl和Na2CO3形成的固体混合物组成时,进行了以下实验:取40 g固体混合物配成溶液,平均分为四份,然后分别加入一定质量分数的CaCl2溶液,实验数据见下表:
|
| 实验一 | 实验二 | 实验三 | 实验四 |
| 原固体混合物质量 | 10g | 10g | 10g | 10g |
| 加入CaCl2溶液质量 | 10g | 20g | 30g | 40g |
| 生成的沉淀的质量 | 2g | m | 5g | 5g |
请分析表中数据回答并计算[(4)要求写计算过程 ]
(1)生成的沉淀是(填写化学式) 。
(2)10g原固体混合物配成的溶液和足量CaCl2溶液反应,最多生成沉淀质量为 g。
(3)m= g。
(4)原固体混合物中Na2CO3的质量分数是多少?

| A.元素名称是“硫” | B.元素符号“S” |
| C.元素的质量32.6g | D.核电荷数是1 |
