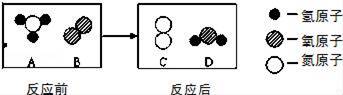
题目内容
逻辑推理是学习化学的一种重要方法.以下推理合理的是( )
A.H2O和H2O2的组成元素相同,所以它们的化学性质相同
B.乙醇完全燃烧生成H2O和CO2,所以乙醇的组成中一定含有C和H元素
C.氧化物中含有氧元素,所以含有氧元素的物质一定是氧化物
D.置换反应有单质生成,但生成单质的反应不一定是置换反应
【考点】物质的元素组成;从组成上识别氧化物;分子的定义与分子的特性;置换反应及其应用;质量守恒定律及其应用.
【专题】物质的微观构成与物质的宏观组成;化学用语和质量守恒定律;化学反应的基本类型和能量变化;物质的分类.
【分析】A.对分子构成的物质来说,分子是保持物质化学性质的最小微粒.从这个角度分析本题;
B.根据质量守恒定律来分析反应前后元素的情况;
C.根据氧化物的概念考虑;
D、由常见的反应类型分析判断.
【解答】解:A.对分子构成的物质来说,分子是保持物质化学性质的最小微粒.H2O和H2O2的组成元素相同,但它们的分子不同,因此它们的化学性质不同.故A错误;
B.根据质量守恒定律,反应前后元素的种类不变.乙醇燃烧生成CO2和H2O,反应后有碳氢氧三种元素,反应前也应有三种元素,又因为反应物质中有氧气,故只能判断蜡烛中一定有碳、氢元素,可能有氧元素.故B正确;
C、氧化物是指由两种元素组成,一种元素是氧元素的化合物,含有氧元素的物质,不一定是由两种元素组成,故错;
D、有单质生成的反应不一定是置换反应,如分解反应也可能会有单质生成,水分解会有氢气和氧气两种单质生成,故D说法正确.
答案:BD.
【点评】本题主要考查了学生根据化学知识进行逻辑推理的化学思维方法,难度不大.

精还原铁粉是一种重要的化工原料,某兴趣小组对其进行下列研究:
【物质制备】利用绿矾制备精还原铁粉的工艺流程如下:

粗还原铁粉中还含有少量铁的氧化物和Fe3C杂质,可用氢气在高温下进一步还原,其反应方程式为:
FexOy+yH2 3Fe+yH2O
3Fe+yH2O
Fe3C+2H2 3Fe+CH4
3Fe+CH4
(1)焙烧中加焦炭的作用:① ;② .
(2)写出焙烧中氧化铁与CO反应的化学方程式: .
【含量测定】为得到精还原铁粉并测定粗还原铁粉中铁的氧化物组成及Fe3C的质量分数,取粗还原铁粉16g,并将其分为2等分,一份与足量的稀盐酸反应,得到氢气0.2g,另一份按如下装置进行实验.(假设每步反应都完全且不考虑装置内原有空气对测定结果的影响).
【资料卡】①3CH4+4Fe2O3 3CO2+6H2O+8Fe
3CO2+6H2O+8Fe
②铁的氧化物及Fe3C均不能与稀盐酸反应产生H2
③浓硫酸的作用吸水,碱石灰吸水和二氧化碳

(3)写出装置中所指定仪器的名称:① ;② .
(4)写出铁与稀盐酸反应的化学方程式: .
(5)主要实验步骤如下:
①按顺序组装仪器,检查装置的气密性,精确称量样品和B、D、E装置的质量;②点燃A处酒精灯;③缓缓通入纯净干燥的H2;④点燃C处酒精灯;⑤分别熄灭A、C处酒精灯;⑥再缓缓通入少量H2;⑦再次精确称量样品及B、D、E装置的质量.
正确操作的先后顺序是①→③→④→②→⑤→⑥→⑦(填序号),否则,测定的Fe3C质量分数 (填“偏大”、“偏小”或“不变”).步骤③的目的是 ,验证该步骤目的达到的实验方法是收集 ;步骤⑥的目的是防 .
(6)经精确称量,实验样品及B、D、E装置反应前后质量的变化如表:
| 样品 | B | D | E | |
| 反应前 | 8g | 350g | 350g | 220g |
| 反应后 | 7.553g | 350.435g | 351.98g | 220.22g |
计算样品中Fe3C质量分数,应选用上表中的 组数据(填“D”或“E”),其理由是 ,则Fe3C质量分数为 (精确到0.01%).
(7)样品中铁的氧化物中,铁、氧元素的质量比是多少?(精确到0.01)(写出计算过程)