题目内容
9. 某同学为了比较铁、铜、锌的活动性顺序,设计了如图所示的实验.
某同学为了比较铁、铜、锌的活动性顺序,设计了如图所示的实验.(1)乙试管中发生反应的化学方程式为Fe+CuSO4═FeSO4+Cu.
(2)上述实验不能完全证明三种金属的活动性顺序.请你补充一个实验.
分析 (1)乙试管中铁与硫酸铜溶液反应生成硫酸亚铁溶液和铜,写出反应的化学方程式即可.
(2)根据位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,进行分析解答.
解答 解:(1)乙试管中铁与硫酸铜溶液反应生成硫酸亚铁溶液和铜,反应的化学方程式为:Fe+CuSO4═FeSO4+Cu.
(2)甲试管中,锌能与硫酸铜溶液反应,说明了金属活动性锌>铜;乙试管中铁与硫酸铜溶液反应,说明了金属活动性铁>铜;无法比较锌和铁的金属活动性,可将锌放入硫酸亚铁溶液中(或将铁放入硫酸锌溶液中).
故答案为:(1)Fe+CuSO4═FeSO4+Cu;(2)将锌放入硫酸亚铁溶液中.
点评 本题难度不大,考查金属活动性应用,掌握金属活动性应用“反应则活泼、不反应则不活泼”是正确解答此类题的关键.

练习册系列答案
相关题目
8.如图为两种物质间发生化学反应的微观示意图(一种小球代表一种原子).下列说法中正确的是( )

| A. | 该反应属于复分解反应 | B. | 1个甲分子由5个原子组成 | ||
| C. | 该示意图中共有2种化合物分子 | D. | 反应中乙、丁两物质的质量比为1:2 |
4.如图为两种气体发生化学反应的微观示意图,其中相同的球代表相同的原子,你认为下列说法正确的是( )


| A. | 化学反应前后原子个数没有改变 | B. | 分子是化学变化中的最小微粒 | ||
| C. | 反应前后各元素化合价没有改变 | D. | 该反应不是化合反应 |
14.人类每时每刻都离不开空气,通过治理,衡阳市的空气质量近年来有所好转,下列关于空气的说法不正确的是( )
| A. | 空气是由多种单质和化合物组成的混合物 | |
| B. | 空气中含量较多且化学性质活泼的是氮气 | |
| C. | 呼吸、燃烧、炼钢、化工生产等都要用到氧气 | |
| D. | 在空气成分中,稀有气体所占比率虽然很小,但它们却是一类很重要的气体 |
18.下列各组物质能够在pH=1的溶液中大量共存,且溶液为无色透明的是( )
| A. | Mg(NO3)2、CuSO4、NaCl | B. | CaCl2、Na2CO3、AgNO3 | ||
| C. | K2SO4、NaNO3、NH4Cl | D. | BaCl2、Na2SO4、NaOH |
19.下列各组物质不宜用于实验室制取气体的是( )
| A. | 块状石灰石与稀盐酸 | B. | 块状大理石与稀硫酸 | ||
| C. | 锌与稀硫酸 | D. | 氯酸钾与二氧化锰 |
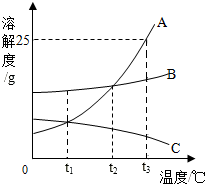 A、B、C三种固体物质在水中的溶解度曲线如图所示,请回答:
A、B、C三种固体物质在水中的溶解度曲线如图所示,请回答: