题目内容
【题目】(7分)某同学在电视寻宝节目中,看到一些铜制文物上有绿色的锈迹,并对绿色锈迹产生了探究兴趣。
【查阅资料】
①绿色锈迹是碱式碳酸铜[Cu2(OH)2CO3],受热易分解。
②无水硫酸铜为白色粉末,遇水变蓝。
③碱石灰是CaO和NaOH的固体混合物,NaOH与CO2反应生成碳酸钠固体和水。
④氧化铜与稀硫酸反应生成蓝色溶液,碳粉不与稀硫酸反应也不溶解在稀硫酸中。
【发现问题】
查阅资料后,该同学将少量碱式碳酸铜放入试管中加热,发现试管中的固体由绿色变成黑色,同时试管壁上有无色液滴生成。
为了进一步确定碱式碳酸铜受热分解的产物,进行了如下探究:
探究一:碱式碳酸铜受热分解生成的黑色固体的成分。
【猜想与假设】该黑色固体可能是①碳粉;② ;③碳和氧化铜的混合物。
【设计方案】请帮助该同学完成下述实验报告。
实验操作与现象 | 实验结论 |
猜想②正确 |
探究二:碱式碳酸铜受热分解还会生成CO2和H2O。
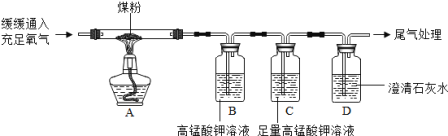
【进行实验】选择如下图所示装置进行验证。

步骤一:连接A和B,打开活塞,通入一段时间的空气。
步骤二,关闭活塞,依次连接装置A→B→ → (填“C”、“D”)。
步骤三:点燃酒精灯,观察到明显现象后,停止加热。
【解释与结论】
①当观察到 ,说明碱式碳酸铜受热分解生成了CO2和 H2O,写出C中反应的化学方程式 。
②Cu2(OH)2CO3受热分解的化学方程式 。
【反思与评价】
上述装置中A的作用是 。
【答案】【猜想与假设】氧化铜(或CuO)
【设计方案】取黑色粉末,加入足量稀硫酸,充分反应后,黑色固体全部溶解形成蓝色溶液。
【进行实验】DC(1分)
【解释与结论】
①C中石灰水变浑浊,D中无水硫酸铜变蓝 CO2 + Ca(OH)2=CaCO3↓+ H2O
②Cu2(OH)2CO3 ![]() 2CuO + H2O + CO2↑
2CuO + H2O + CO2↑
【反思与评价】除去空气中的水分和二氧化碳,防止对产物的检验造成干扰。
【解析】
试题分析:依据质量守恒定律化学反应前后元素的种类不变,故黑色固体还可能是氧化铜;碳粉不能与硫酸反应,氧化铜能与硫酸反应生成蓝色溶液,故向黑色固体中加入足量的硫酸,若黑色固体全部溶解,溶液由无色变成蓝色,则说明猜想2正确;碱石灰能吸收空气中的二氧化碳且有干燥的作用,可以除去空气中的水分和二氧化碳,防止对产物的检验造成干扰。根据资料,水用无水硫酸铜检验,二氧化碳用澄清的石灰水检验。先把生成的气体通入无水硫酸铜,若无水硫酸铜变蓝则说明分解生成了水,若澄清的石灰水变浑浊则说明生成了二氧化碳;

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案