题目内容
1 )实验室可用草酸(H2C2O4)在浓硫酸的作用下分解制得一氧化碳和二氧化碳(化学方程式为:H2C2O4
)实验室可用草酸(H2C2O4)在浓硫酸的作用下分解制得一氧化碳和二氧化碳(化学方程式为:H2C2O4 CO2↑+CO↑+H2O)。用的实验装置如下图所示:
CO2↑+CO↑+H2O)。用的实验装置如下图所示:

若分别得到一氧化碳和二氧化碳,请回答:
①装置A中,盛放浓硫酸的仪器名称是_ _;
②收集一氧化碳时,打开a、b,关闭c,装置B的作用是_ _。由于一氧化碳有毒,多余的气体应_ (填写具体处理办法);
③关闭_、打开_,释放出二氧化碳,并通过装置_可收集到干燥的二氧化碳气体。
(2)在二氧化锰的催化作用下,过氧化氢迅速分解生成氧气和水。哪些因素还影响着过氧化氢分解的速率?课外活动小组就此进行了更深入的探究:
探究实验一:浓度对化学反应速率的影响
| 实验步骤 | 现象 | 结论 |
| 取一支试管加入3~5 mL5%的过氧化氢溶液,然后加入少量二氧化锰。 | 缓慢,有少量气泡冒出 | |
| 另取一支试管加入3~5 mL15%的过氧化氢溶液,然后加入少量二氧化锰。 | 迅速,有大量气泡冒出 | _ _ |
请你设计:
实验用品:试管、烧杯、热水、冷水、5%过氧化氢溶液、 15%过氧化氢溶液
15%过氧化氢溶液
探究实验二:温度对化学反应速率的影响
分液漏斗
吸收混合气体中的二氧化碳 点燃处理(或用气囊收集)_ b_ c_ C、D_
浓度越大,过氧化氢分解的速率越快
| 实验步骤 | 现象 | 结论 |
| 取一支试管加入3~5 mL15%的过氧化氢溶液,然后把试管放入盛有冷水的烧杯中 | 缓慢有大量气泡冒出 | |
| 取一支试管加入3~5 mL15%的过氧化氢溶液,然后把试管放入盛有热水的烧杯中 | 迅速有大量气泡冒出 | 温度越高,过氧化氢分解的速率越大 |

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案实验室中的药品一般要密封保存,否则可能会与空气接触而变质。某研究性学习小组的同学对实验里久置于空气中变质的过氧化钠(Na2O2)固体的成分进行探究。
(1)Na2O2的化学性质很活泼,能与水、二氧化碳反应,相关反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2=2Na2CO3+O2↑
(2)CaCl2溶液为中性
Ⅰ.固体为Na2O2、NaOH、Na2CO3的混合物
Ⅱ.固体为NaOH和Na2CO3的混合物
Ⅲ.固体为NaOH
Ⅳ.固体为Na2CO3
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量固体于试管中,加水振荡,直至完全溶解 | ||
| _无明显现象(或无气泡产生)_ | 猜想Ⅰ | |
| 不成立 | ||
| ②取少量①的溶液于试管中,滴加CaCl2溶液至过量 | ||
| _产生白色沉淀_ | 证明有 | |
| Na2CO3 | ||
| 存在 | ||
| ③_取少量②的溶液于试管中,滴加几滴无色酚酞试液,振荡_ | ||
| _酚酞试液变红_ | 证明 | |
| NaOH | ||
| 存在 | ||
| 综合以上实验现象,说明猜想Ⅱ是成立的。 |
(1)实验操作②中反应的化学方程式为_ _。
(2)实验操作②中“滴加CaCl2溶液至过量”的目的是_ _。


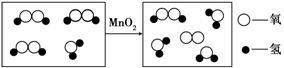
 __。
__。 化合价__,该化学反应中不发生改变的微观粒子是__ __(填“原子”或“分子”),上述反应过程中的MnO2用作__ __剂。
化合价__,该化学反应中不发生改变的微观粒子是__ __(填“原子”或“分子”),上述反应过程中的MnO2用作__ __剂。 内)不正确的是
内)不正确的是