题目内容
要除去粗盐中含有的Na2SO4、MgCl2、CaCl2和泥沙等杂质,且又不混入其它杂质,小刚他们设计了一个实验方案:将粗盐溶于水,过滤得到澄清溶液,再进行下列各步骤处理:①加入NaOH溶液至沉淀完全;②加入________溶液至沉淀完全;③加入_______溶液至沉淀完全;④过滤,取出滤液;⑤往滤液中加入_______溶液调至溶液的pH=7;⑥蒸发浓缩,使NaCl 晶体析出.上述方案的步骤②、步骤③和步骤⑤中所加的物质,你认为分别是( )
| A、Ba(NO3)2Na2CO3 HCl |
| B、BaCl2 K2CO3 H2SO4 |
| C、BaCl2 Na2CO3 HCl |
| D、Ba(NO3)2 K2CO3 H2SO4 |
考点:氯化钠与粗盐提纯,盐的化学性质
专题:常见的盐 化学肥料
分析:从电离的角度分析粗盐中的杂质可知:溶液中的杂质离子为钙离子、镁离子、和硫酸根离子,根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后可以将过量的钡离子沉淀;最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析.
解答:解:A、加入硝酸钡会引入新的杂质离子硝酸根离子,故A错误;
B、加入的试剂碳酸钾和硫酸会引入新的杂质离子钾离子和硫酸根离子,故B错误;
C、加入氢氧化钠溶液可以把镁离子转化成氢氧化镁沉淀,加入氯化钡溶液可以把硫酸根离子转化成硫酸钡沉淀,加入碳酸钠溶液可以把钙离子、钡离子转化成碳酸钙、碳酸钡沉淀,最后在滤液中加入稀盐酸,使稀盐酸和过量的氢氧化钠、碳酸钠反应,从而使溶液的PH=7,故C正确;
D、加入的硝酸钡、碳酸钾、硫酸都会引入新的杂质离子:硝酸根离子、钾离子、硫酸根离子,故D错误;
故选:C.
B、加入的试剂碳酸钾和硫酸会引入新的杂质离子钾离子和硫酸根离子,故B错误;
C、加入氢氧化钠溶液可以把镁离子转化成氢氧化镁沉淀,加入氯化钡溶液可以把硫酸根离子转化成硫酸钡沉淀,加入碳酸钠溶液可以把钙离子、钡离子转化成碳酸钙、碳酸钡沉淀,最后在滤液中加入稀盐酸,使稀盐酸和过量的氢氧化钠、碳酸钠反应,从而使溶液的PH=7,故C正确;
D、加入的硝酸钡、碳酸钾、硫酸都会引入新的杂质离子:硝酸根离子、钾离子、硫酸根离子,故D错误;
故选:C.
点评:本题主要考查复分解反应发生的条件,只有掌握了复分解反应发生的条件,才能判断物质之间能否发生反应,从而选择合适的试剂把杂质除去,并要注意加入试剂的作用和顺序.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列关于空气及其成分的说法中,不正确的是( )
| A、空气中氮气含量最多,氮气可以作粮食瓜果的保护气 |
| B、空气是成分固定不变的气体 |
| C、空气中的二氧化碳含量过多时,会对人体产生有害影响 |
| D、空气中含有水蒸气,所以松脆的食物长时间放在空气中易变软 |
 下列实验内容中的横、纵坐标表示的量符合如图所示变化趋势的是( )
下列实验内容中的横、纵坐标表示的量符合如图所示变化趋势的是( )| 序号 | 实验内容 | 横坐标表示的量 | 纵坐标表示的量 |
| ① | 饱和氯化钠溶液的稀释 | 加入水的体积 | 溶质质量分数 |
| ② | 向硫酸铜溶液中加入过量的铁粉 | 时间 | 溶液的质量 |
| ③ | 过氧化氢溶液与二氧化锰制氧气 | 时间 | 二氧化锰质量 |
| ④ | 向饱和石灰水中加入氧化钙 | 时间 | 溶剂的质量 |
| A、①② | B、②③④ | C、②④ | D、②③ |
下列图象能正确反映对应变化关系的是( )
A、 一定温度下,向不饱和硝酸钾溶液中加入硝酸钾 |
B、 在一定质量的AgNO3和Cu(NO3)2的混合溶液中加入铁粉 |
C、 两份质量和浓度都相同的H2O2溶液在有无MnO2的情况下,产生O2的质量与时间t的关系 |
D、 向相等质量的镁、铝、锌、铁四种金属中,加入足量的稀盐酸 |
初中化学的很多反映可以表示为:甲+乙=丙+丁,其中甲、乙、丙、丁既可能是单质也可能是化合物.下列说法中,正确的是( )
| A、若甲是单质,乙是化合物,则丙或丁至少有一个是单质 |
| B、若甲、乙、丙分别是酸、碱、盐,则丁一定是水 |
| C、若甲、乙、丙、丁均是化合物,则该反应一定是复分解反应 |
| D、若甲是锌,丙是氢气,则乙一定是稀硫酸 |
 某原子结构示意图如图,与它属于同种元素的是( )
某原子结构示意图如图,与它属于同种元素的是( )A、 |
B、 |
C、 |
D、 |
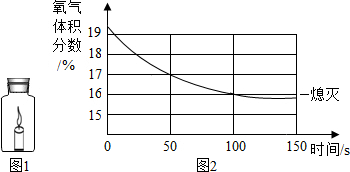 蜡烛(足量)在如图1密闭的集气瓶内燃烧至熄灭,用仪器测出瓶内氧气含量的变化如图2所示.下列判断正确的是( )
蜡烛(足量)在如图1密闭的集气瓶内燃烧至熄灭,用仪器测出瓶内氧气含量的变化如图2所示.下列判断正确的是( )| A、蜡烛燃烧前瓶内只有氧气 |
| B、蜡烛熄灭后瓶内只剩二氧化碳气体 |
| C、反应后有气体生成所以瓶内物质总质量减小 |
| D、氧气浓度小于一定值时,蜡烛无法燃烧 |