题目内容
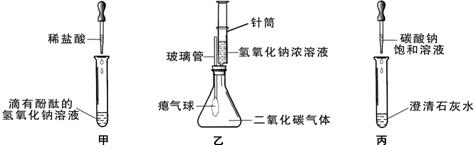
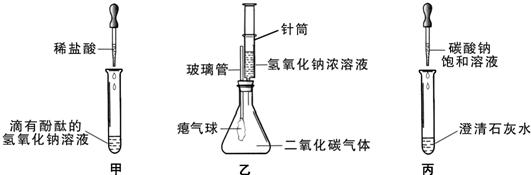
(10分)同学们在学习碱的化学性质时,进行了如下图所示的实验。
(1)写出甲实验中盐酸和氢氧化钠反应的化学方程式 。
(2)乙实验中滴加氢氧化钠溶液后,可观察到的现象是 。
(3)丙实验中观察到试管内有白色沉淀产生。
(4)实验结束后,同学们将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,产生疑问。
【提出问题】 废液中含有哪些物质?
【交流讨论】①一定含有的物质:碳酸钙、指示剂、水和 (写物质名称) 。
②还含有能使废液呈碱性的物质。能使废液呈碱性的物质是什么?同学们有
如下猜想。
小云认为:只有碳酸钠
小红认为:只有氢氧化钙
小林认为:是氢氧化钠和碳酸钠
你认为还可能是 。
(写一种猜想)
【实验设计】小方想用氯化钙溶液来验证小云、小红、小林的猜想。查阅资料获悉氯化钙溶液呈中性,并设计如下实验。请你将小方的实验设计补充完整。
| 实验内容 | 预计现象 | 预计结论 |
| 取少量废液缸中上层清液于试管中,加入过量氯化钙溶液,静置。 | ①有白色沉淀,溶液呈红色。 | 的猜想正确。 |
| ② 。 | 的猜想正确。 | |
| ③ 。 | 的猜想正确。 |
(1)NaOH+HCl===NaCl+H2O (2)气球胀大
(4)
【交流讨论】① NaCl ②氢氧化钠(合理答案均可)
【实验设计】 ①小林
②有白色沉淀,溶液由红色变为无色 小云
③ 没有白色沉淀,溶液呈红色 小红 (合理答案均可)
【反思拓展】 反应物是否有剩余 (合理答案均可)
解析试题分析:(1)氢氧化钠能够使酚酞变红,加入盐酸后会发生中和反应,生成氯化钠和水,反应的化学方程式为:NaOH+HCl===NaCl+H2O ;
(2)氢氧化钠会与二氧化碳反应生成碳酸钠和水,瓶内二氧化碳被反应掉后,瓶内气压减小,外界大气压将把空气压入气球内,故能看到气球胀大。
(3)在丙实验中,碳酸钠与氢氧化钙反应生成碳酸钙和氢氧化钠,结合甲和乙的实验可知,整个实验结束后所得的废液中还应含有氯化钠;
(4)碱性物质能使酚酞变红色,废液呈现红色,说明废液显碱性,结合甲、乙、丙实验,根据组合知识可知,废液中还有可能含有氢氧化钠;
(5)因氯化钙能与碳酸钠反应生成碳酸钙沉淀和氯化钠,生成物不呈碱性,但题中若有白色沉淀,溶液还呈红色,则说明溶液中还有碱性物质存在,即溶液中含有氢氧化钠和碳酸钠,故小林的猜想正确;若有白色沉淀,溶液由红色变为无色,则小云的猜想正确;若没有白色沉淀,溶液呈红色,则小红的猜想正确。
(6)在分析化学反应后所得物质的成分时,除了考虑生成物外还需考虑反应物是否有剩余 (合理答案均可)。
考点:碱的化学性质;酸的化学性质;书写化学方程式。
点评:本题主要研究了由于反应物的量不同导致的生成物就不会相同的具体反应,综合性较强。