题目内容
请结合下列实验常用装置,回答有关问题.

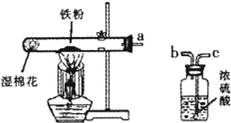
(1) 写出图中标有字母的仪器名称:a 、b .
写出图中标有字母的仪器名称:a 、b .
(2)若用高锰酸钾制取氧气,应选择的发生装置是(填字母,下同) ,反应的化学方程式是 .用排水法收集完氧气,应先将导管移出水面,然后再停止加热,主要是防止 .
(3)若用石灰石和稀盐酸来制取二氧化碳,可选用B或C作为发生装置,这两种装置相比,C装置优点是 .该反应的化学方程式为 .
(4)甲烷是密度小于空气,极难溶于水的气体.实验室用加热醋酸钠固体和碱石灰固体混合物的方法来制取.制取甲烷应选用的发生装置是 ,若要收集较纯的甲烷,可选择D、E、F中的 .若用图G所示医用塑料袋排空气法收集甲烷,则甲烷进入端为(填“a”或“b”) .
【考点】常用气体的发生装置和收集装置与选取方法;实验室制取氧气的反应原理;制取氧气的操作步骤和注意点;二氧化碳的实验室制法;书写化学方程式、文字表达式、电离方程式.
【专题】常见气体的实验室制法、检验、干燥与净化.
【分析】(1)直接写出图中所标的仪器的名称;
(2)发生装置的选择要根据反应物的状态和反应条件;据高锰酸钾制取氧气的反应原理及注意事项解答;
(3)根据二氧化碳的实验室制法以及二氧化碳的性质即可判断;
(4)发生装置的选择要根据反应物的状态和反应条件,收集装置要根据气体的密度和溶水性.
【解答】解:(1)图中所给仪器的名称为:a长颈漏斗;b锥形瓶;
(2)由于需要加热应该选用有酒精灯的装置;写方程式要注意一写二配三注明四等号.用高锰酸钾制氧气配平方法是用观察法配平;用排水法收集完氧气,应先将导管移出水面,然后再停止加热,主要是防止防止水槽中的水倒流回试管,引起试管的破裂;
(3)B和C相比,C装置中导管多了一个开关,一旦开关关闭,随着气体的增多,迫使液体和多孔隔板上的固体分离,导致反应停止;反应的方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(4)实验室用加热无水醋酸钠和碱石灰固体混合物的方法来制取甲烷,所以应该用A装置作为发生装置,由于排水法收集的气体较纯,而甲烷难溶于水,所以应该用排水法来收集得到较纯的甲烷即D装置;甲烷的密度比空气小,所以也可以用向下排空气法收集甲烷,若用F装置来收集甲烷,应该从b中进入集气瓶.
故答案为:(1)长颈漏斗;锥形瓶;
(2)A;2KMnO4 K2MnO4+MnO2+O2↑; 防止水槽中的水倒流回试管,引起试管的破裂;
K2MnO4+MnO2+O2↑; 防止水槽中的水倒流回试管,引起试管的破裂;
(3)控制反应的发生和停止; CaCO3+2HCl═CaCl2+H2O+CO2↑;
(4)A; D;b.
【点评】熟练掌握实验中选择收集装置和发生装置的依据,其中气体制取装置的选择要看反应物的状态和反应条件;收集装置的选择要看气体的密度和溶水性.

向烧杯中逐滴加入X溶液至过量(图甲),生成沉淀或气体的质量(纵坐标)与加入X溶液的质量(横坐标)关系不符合图乙的是( )
| 烧杯中的物质 | X溶液 | |
| A | 稀硫酸 | 氯化钡溶液 |
| B | 稀硫酸和硫酸铜溶液 | 氢氧化钠溶液 |
| C | 氯化钙溶液 | 碳酸钠溶液 |
| D | 碳酸氢钠溶液 | 稀盐酸 |

A.A B.B C.C D.D
“五一”假期,小兵对“锌与硫酸反应快慢的影响因素”进行了探究.
【提出问题】锌与硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】a.可能与硫酸的质量分数有关;b.可能与锌的形状有关.
【设计并实验】小兵用不同质量分数的硫酸和不同形状的锌进行如下实验.
| 实验编号 | 硫酸的质量分数(均取20mL) | 锌的形状(均取1g) | 氢气的体积(mL)(均收集3分钟) |
| ① | 30% | 锌粒 | 31.7 |
| ② | 20% | 锌片 | 50.9 |
| ③ | 20% | 锌粒 | 61.7 |
| ④ | 30% | 锌片 | 79.9 |
(1)写出稀硫酸与锌反应的化学方程式 .
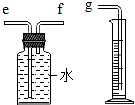
(2)小兵用如图装置收集并测量氢气的体积,其中量筒的作用是 ,
氢气应从 (填e或f或g)管通入.
(3)若用该收集CO2,并测量生成的CO2气体的体积,其中在水面上放一层植物油目的是 ;
【收集证据】(4)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是 .
【得出结论】(5)结论是
【评价与反思】(注意:若答对(5)(6)两小题奖励4分,化学试卷总分不超过60分)
(6)下表是小兵第①组实验的详细数据.
| 时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| H2的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 7.6mL | 6.0mL |
请描述锌与硫酸反应的快慢的变化并解释原因 .
(7)锌与硫酸反应的快慢可能还受哪些因素影响?设计实验验证. .