题目内容
1.实验室对一瓶标签破损的H2S04溶液进行测定,取20.0g硫酸样品于锥形瓶中,逐滴加入16%的Na0H溶液,并对溶液进行pH监测,所得数据如表所示:| 滴加NaOH溶液的质量/g | 9.0 | 9.4 | 9.8 | 10.0 | 10.2 |
| 溶液的pH | 1.8 | 2.1 | 2.6 | 7.0 | 11.4 |
(1)当滴加NaOH溶液的质量为9.4g时,溶液中的溶质是H2SO4、Na2SO4.
(2)计算所测H2SO4溶液中溶质的质量分数.
分析 硫酸与氢氧化钠溶液反应生成硫酸钠和水,至pH=7时,恰好完全反应,此时消耗的氢氧化钠溶液的质量为10.0g,由氢氧化钠溶液中溶质的质量分数,由反应的化学方程式列式计算出参加反应的硫酸的质量,进而计算出H2SO4溶液中溶质的质量分数.
解答 解:(1)当滴加NaOH溶液的质量为9.4g时,溶液的pH为2.1,溶液显酸性,说明稀盐酸过量,所得溶液中的溶质为H2SO4、Na2SO4.
(2)10.0g氢氧化钠溶液中溶质的质量为10.0g×16%=1.6g.
设参加反应的硫酸的质量为x
2NaOH+H2SO4═Na2SO4+2H2O
80 98
1.6g x
$\frac{80}{98}=\frac{1.6g}{x}$ x=1.96g
所测H2SO4溶液中溶质的质量分数为$\frac{1.96g}{20.0g}$×100%=9.8%.
答:(1)H2SO4、Na2SO4;(2)所测H2SO4溶液中溶质的质量分数为9.8%.
点评 本题难度不大,掌握利用化学方程式与溶质质量分数的综合计算即可正确解答本题,解题时要注意解题的规范性.

练习册系列答案
相关题目
11.在一个密闭容器中加入四种物质,在一定条件下充分反应,测得反应前后各物质的质量如表:
通过分析,判断下列说法正确的是( )
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反成前质量/g | 3 | 5 | 20 | 7 |
| 反应后质量/g | 10 | 5 | 8 | 待测 |
| A. | 乙物质一定是催化剂 | B. | 测得反应后丁物质的质量为12g | ||
| C. | 该反应是化合反应 | D. | 该反应是复分解反应 |
12.如图图标属于禁止烟火的是( )
| A. |  | B. |  | C. |  | D. |  |
9.下列有关实验室制取气体的说法错误的是( )


| A. | 装置①可作为CO2的发生装置 | B. | 装置④是收集CO2气体的验满方法 | ||
| C. | 装置③可用作O2的收集装置 | D. | 装置②干燥O2时,气体由a管进b管出 |
 如图是某品牌电饭煲的示意图.
如图是某品牌电饭煲的示意图. A、B、C、D、E、F是碳酸钠溶液、稀盐酸、氢氧化钙溶液、二氧化碳,一种氧化物和一种未知溶液,用连线表示能反应,箭头表示可以转化.试回答问题.
A、B、C、D、E、F是碳酸钠溶液、稀盐酸、氢氧化钙溶液、二氧化碳,一种氧化物和一种未知溶液,用连线表示能反应,箭头表示可以转化.试回答问题.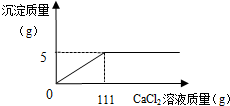 某碳酸钠和氯化钠的混合粉末21.2g,不断加入CaCl2溶液,产生沉淀的质量与所加入的CaCl2溶液的关系如图所示.
某碳酸钠和氯化钠的混合粉末21.2g,不断加入CaCl2溶液,产生沉淀的质量与所加入的CaCl2溶液的关系如图所示. 已知A、B、C、D、E均为初中化学常见的物质,相互关系如图所示,“→”表示转化关系,“-”表示相互之间反应(部分反应物、生成物以及反应条件省略).其中A是人体胃酸的主要成分,C是一种常用的食品干燥剂,与水反应放出大量的热,E是地壳中含量居第二位的金属元素组成的单质,请回答:
已知A、B、C、D、E均为初中化学常见的物质,相互关系如图所示,“→”表示转化关系,“-”表示相互之间反应(部分反应物、生成物以及反应条件省略).其中A是人体胃酸的主要成分,C是一种常用的食品干燥剂,与水反应放出大量的热,E是地壳中含量居第二位的金属元素组成的单质,请回答: