题目内容
碳酸钙是牙膏中一种常用的摩擦剂,可用石灰石作原料来制备。某牙膏厂现有一批石灰石样品,小丽为探究石灰石原料所含碳酸钙的质量分数。称取500g样品,磨成粉末后,放在电炉上高温煅烧至质量不再发生变化,称量剩余固体质量为302g。(有关反应的化学方程式为:CaCO3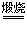 CaO+CO2↑,假设石灰石样品中杂质不参加反应。)
CaO+CO2↑,假设石灰石样品中杂质不参加反应。)
请计算:
(1)生成二氧化碳的质量;
(2)此石灰石样品中碳酸钙的质量分数。
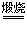 CaO+CO2↑,假设石灰石样品中杂质不参加反应。)
CaO+CO2↑,假设石灰石样品中杂质不参加反应。)请计算:
(1)生成二氧化碳的质量;
(2)此石灰石样品中碳酸钙的质量分数。
解:
(1)500g-302g=198g
(2)设参加反应的CaCO3质量为x。
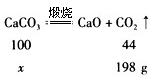
100:x=44:198g
x =450g
450g÷500g×100%=90%
(1)500g-302g=198g
(2)设参加反应的CaCO3质量为x。
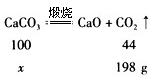
100:x=44:198g
x =450g
450g÷500g×100%=90%

练习册系列答案
相关题目
普通牙膏常选用细粉末状且不溶于水的氢氧化铝、碳酸钙、二氧化硅中的一种物质作为摩擦剂,以增强刷牙的效果.现取某牙膏50.0克,放入烧杯中,在加入200克的稀盐酸(足量),充分反应后所的混合物的质量为239.0克.他对实验的推断正确的是
( )
( )
| A、此摩擦剂一定是碳酸钙 | B、此牙膏摩擦剂的质量分数是50% | C、此稀盐酸的质量分数不低于8% | D、此变化无气体放出 |


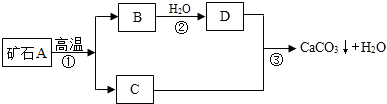
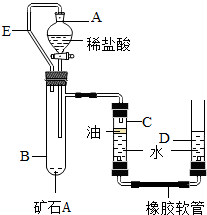 【实验原理】:测定一定质量的矿石A与足量稀盐酸反应产生的二氧化碳在常温常压下的体积,根据密度求出二氧化碳的质量,然后根据发生的化学反应方程式算出矿石A中碳酸钙的质量,进而求出矿石A中碳酸钙的质量分数.
【实验原理】:测定一定质量的矿石A与足量稀盐酸反应产生的二氧化碳在常温常压下的体积,根据密度求出二氧化碳的质量,然后根据发生的化学反应方程式算出矿石A中碳酸钙的质量,进而求出矿石A中碳酸钙的质量分数. 不能确定的是
不能确定的是