题目内容
【题目】A~K为初中常见物质,它们之间转化关系如下图。其中C、F为单质,其他为化合物;D溶液为蓝色、I俗称为纯碱、K用于建筑材料;反应②中能够观察到黑色粉末变红,反应③中有明显的热量放出(部分反应的反应条件、反应物和生成物已略去)
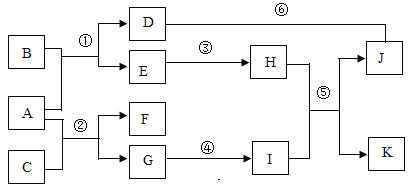
回答下列问题:
(1)写出物质的化学式: F ________;H_________。
(2)反应④的化学方程式为__________。
(3)反应⑥的化学方程式为__________。
(4)在上述反应中,未出现的基本反应类型是__________。
【答案】Cu Ca(OH)2 ![]()
![]() (合理即可) 分解反应
(合理即可) 分解反应
【解析】
I俗称为纯碱,纯碱是碳酸钠的俗名,I是碳酸钠,I能与H反应生成K和J,K用于建筑材料,碳酸钠能与氢氧化钙反应生成碳酸钙和氢氧化钠,可推出K是碳酸钙,则H为氢氧化钙,J是氢氧化钠, D溶液为蓝色,且D和J反应,D是可溶性铜盐,如硫酸铜,反应②中能够观察到黑色粉末变红,C、F为单质,且G能转化为碳酸钠,可推出A为氧化铜、C为碳、F为铜,G为二氧化碳,反应③中有明显的热量放出,B和A生成D和E,E生成H,可推出E是水,B是硫酸,代入验证,符合题意。
(1)F是铜,故物质的化学式Cu;H是氢氧化钙,化学式为:Ca(OH)2。
(2)反应④是二氧化碳和氢氧化钠反应生成碳酸钠和水,反应的化学方程式为![]() 。
。
(3)反应⑥是氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,反应的化学方程式为![]() 。
。
(4)反应①是氧化铜和稀硫酸反应生成硫酸铜和水,属于复分解反应,反应②是碳和氧化铜在高温下反应生成铜和二氧化碳,属于置换反应,反应③是氧化钙和水反应生成氢氧化钙,属于化合反应,反应④是二氧化碳和和氢氧化钠反应生成碳酸钠和水,不属于基本反应类型,反应⑤是碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,属于复分解反应,反应⑥是氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,属于复分解反应,故在上述反应中,未出现的基本反应类型是分解反应。

【题目】为探究某塑料的元素组成,某实验小组设计了实验I和Ⅱ。回答下列问题:
I.制取氧气
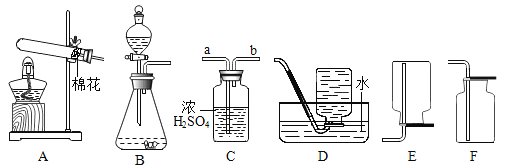
(1)A中用于加热的仪器名称是_______________;若用一种暗紫色固体制取干燥的O2,发生反应的化学方程式为____________,选择的装置组合为__________ (填字母)。
Ⅱ.组成探究
(2)定性检测(已知:无水CuSO4遇水变蓝色)
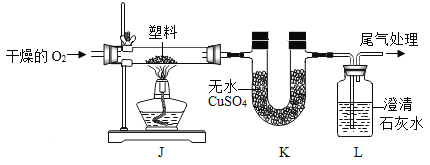
实验操作 | 实验现象 | 结论 |
连接装置,检查气密性,装入试剂并按上图进行实验。通入干燥的O2,一段时间后,点燃J处酒精灯 | ①装置K中无水CuSO4变__色 | 塑料燃烧产物中有H2O |
②装置L中__________ | 塑料燃烧产物中有CO2 |
③由上述实验可知,该塑料一定含有的元素是___________(填元素符号)。
【题目】某矿样含有大量的 CuS 及少量其它不溶于水、不与酸反应的杂质。实验室中 以该矿样为原料制备CuSO4·5H2O晶体,并最终制取碱式碳酸铜。
I. 制备CuSO4·5H2O晶体
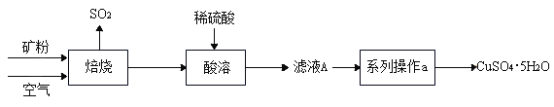
(1)矿样中 CuS 在空气中焙烧生成了 CuO,反应方程式为___;
(2)在实验室中,欲用 98%、密度1.84g/cm3的浓硫酸配制500 g质量分数10%的稀硫酸, 需要的仪器除量筒、烧杯、玻璃棒外,还有___。稀释过程___(填“放热”或“吸 热”)。
(3)若在实验室中完成系列操作 a,主要步骤为____→降温结晶→____→洗涤→低温干燥。(以上选填字母)
II. 制备碱式碳酸铜
(4)实验室制备碱式碳酸铜的反应原理为:(将短线上的物质补充完整)
![]() ____↑+2Na2SO4。
____↑+2Na2SO4。
(5)分别取 50mL一定浓度的CuSO4溶液与Na2CO3 溶液混合,发现反应后烧杯底部出现大量蓝绿色沉淀。查阅资料得知蓝绿色沉淀中混有难溶于水的碱式硫酸铜[Cu2(OH)2SO4]。为确定该物质,经过滤、洗净后取少量固体于试管中,加入足量稀盐酸将固体完全溶解,再滴加几滴____溶液出现白色沉淀,证明含有Cu2(OH)2SO4。
(6)按最佳配比进行实验制备碱式碳酸铜,反应过程中测得数据如下:
温度/℃ | 60 | 65 | 75 | 80 | 90 |
沉淀量/g | 1.295 | 1.303 | 1.451 | 1.340 | 1.292 |
据此分析制备反应控制的适宜温度是____,推测 90°C固体较少的原因是____。
(7)查阅资料可知碱式碳酸铜的组成有多种,可用xCu(OH)2yCuCO3表示。某小组利用 以下装置测定某碱式碳酸铜样品的组成:(资料:碱式碳酸铜受热分解成三种常见的氧化物;碱石灰是氧化钙与氢氧化钠的混合物)
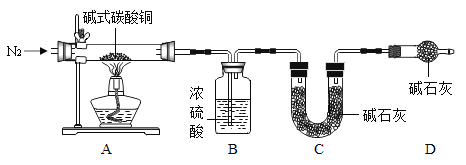
①加热时持续通入N2的目的是____,D 装置的作用是____。
②称取 32.0g 样品,充分反应后得到 24.0g 残留物,B 增重 3.6g,C 增重 4.4g。该样品的化学式为____。若对调 B 和 C 装置的位置,____(填“能”或“不能”)测算出该样品的化学式。